
Tipi, struttura e organizzazione del miofilamento
Il miofilamenti sono le proteine contrattili delle miofibrille, che sono le unità strutturali delle cellule muscolari, cellule allungate chiamate fibre muscolari.
Le fibre muscolari e le loro componenti hanno nomi particolari. Ad esempio, la membrana, il citoplasma, i mitocondri e il reticolo endoplasmatico sono noti rispettivamente come sarcolemma, sarcoplasma, sarcosomi e reticolo sarcoplasmatico..
Allo stesso modo, gli elementi contrattili all'interno sono chiamati congiuntamente miofibrille; e le proteine contrattili che compongono le miofibrille sono chiamate miofilamenti.
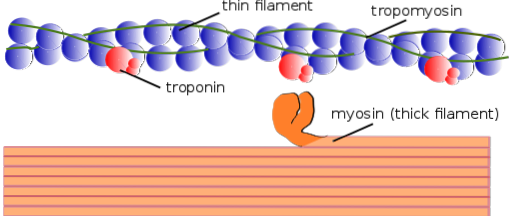
Esistono due tipi di miofilamenti: sottili e spessi. I filamenti sottili sono costituiti principalmente da tre proteine: F-actina, tropomiosina e troponina. I filamenti spessi, nel frattempo, sono costituiti esclusivamente da un'altra proteina nota come miosina II.
Oltre a queste, esistono altre proteine associate a filamenti sia spessi che sottili, ma questi non hanno funzioni contrattili, ma piuttosto strutturali, tra cui, per citarne alcune, titina e nebulina.
Indice articolo
- 1 Tipi di fibre muscolari
- 2 Struttura
- 2.1 Miofilamenti sottili
- 2.2 Miofilamenti spessi
- 3 Organizzazione
- 3.1 Come sono organizzati i miofilamenti all'interno dei sarcomeri?
- 4 Meccanismo di contrazione
- 5 Riferimenti
Tipi di fibre muscolari
La particolare disposizione dei miofilamenti che compongono le miofibrille dà origine a due tipi di fibre muscolari: fibre muscolari striate e fibre muscolari lisce.
Le fibre muscolari striate, quando esaminate al microscopio ottico, mostrano uno schema di striature o bande trasversali che si ripetono su tutta la loro superficie e che danno il nome, al muscolo che le contiene, di muscolo striato. Esistono due tipi di fibre muscolari striate, scheletriche e cardiache.
Le fibre muscolari che non mostrano questo modello di bande trasversali sono chiamate fibre lisce. Sono quelli che compongono i muscoli delle pareti vascolari e dei visceri.
Struttura
Miofilamenti sottili
Questi miofilamenti sono composti da actina F e due proteine associate: tropomiosina e troponina, che hanno funzioni regolatrici..
L'actina F, o actina filamentosa, è un polimero di un'altra proteina globulare più piccola chiamata actina G o actina globulare, di circa 42 kDa di peso molecolare. Ha un sito di legame per la miosina ed è organizzato formando due catene disposte come una doppia elica composta da circa 13 monomeri per giro..
I filamenti di actina F sono caratterizzati dall'avere due poli: uno positivo, diretto verso il disco Z, e l'altro negativo, disposto verso il centro del sarcomero.
La tropomiosina è anche costituita da una doppia catena polipeptidica a doppia elica. È una proteina da 64 kDa che forma filamenti che si trovano nelle scanalature lasciate dalle catene a doppia elica dei sottili filamenti di F-actina, come se "riempissero" gli spazi vuoti dell'elica.
A riposo, la tropomiosina copre o "copre" i siti di legame dell'actina per la miosina, prevenendo l'interazione di entrambe le proteine, che è ciò che causa la contrazione muscolare. Intorno a ciascun filamento sottile ea circa 25-30 m dall'inizio di ciascuna tropomiosina si trova un'altra proteina chiamata troponina.
La troponina (Tn) è un complesso proteico composto da tre subunità polipeptidiche globulari chiamate troponina T, C e I.Ogni molecola di tropomiosina ha un complesso di troponina associato che la regola e insieme sono responsabili della regolazione dell'inizio e della fine della contrazione muscolare..
Miofilamenti spessi
I filamenti spessi sono polimeri di miosina II, del peso di 510 kDa e costituiti da due catene pesanti di 222 kDa ciascuna e quattro catene leggere. Le catene leggere sono di due tipi: catene leggere essenziali da 18 kDa e catene leggere regolamentari da 22 kDa..
Ciascuna catena pesante della miosina II ha la forma di un bastoncino con una piccola testa globulare all'estremità che sporge di quasi 90 ° e ha due siti di legame, uno per l'actina e uno per l'ATP. Questo è il motivo per cui queste proteine appartengono alla famiglia delle ATPasi..
Un filamento spesso è costituito da più di 200 molecole di miosina II. La testa globulare di ciascuna di queste molecole funge da “pagaia” durante la contrazione, spingendo l'actina a cui è attaccata in modo che scivoli verso il centro del sarcomero..
Organizzazione
In una fibra muscolare scheletrica striata, le miofibrille occupano la maggior parte del sarcoplasma e sono disposte in assemblaggi longitudinali e ordinati in tutta la cellula.
In una sezione longitudinale vista al microscopio ottico si osservano bande di luce, chiamate Bande I, e bande scure, chiamate Bande A. Queste bande corrispondono alla disposizione ordinata delle miofibrille, e quindi dei miofilamenti che le compongono..
Al centro della Banda I c'è una linea scura e sottile chiamata Linea o Disco Z. Il centro di ogni Banda A ha un'area più chiara nota come Banda H, che è divisa centralmente da una linea più scura chiamata Linea M.
Delimitata tra due linee Z, viene descritta una struttura chiamata sarcomero, che è l'unità funzionale del muscolo scheletrico. Un sarcomero è composto da miofilamenti contrattili disposti in modo ordinato nelle bande A, H e una emibanda I a ciascuna estremità..
Le bande I contengono solo filamenti sottili, la banda A contiene filamenti spessi intrecciati alle due estremità con filamenti sottili e la banda H contiene solo filamenti spessi.
Come sono organizzati i miofilamenti all'interno dei sarcomeri?
Sia i miofilamenti spessi che quelli sottili possono essere visti quando si esamina un campione di muscolo scheletrico scheletrico al microscopio elettronico. Si dice che questi "interdigitano" o "si intrecciano" tra loro in una disposizione sequenziale, ordinata e parallela..
I sottili filamenti hanno origine dai dischi Z e si estendono su entrambi i lati nella direzione opposta e verso il centro di ciascun sarcomero adiacente. Dai dischi Z a ciascuna estremità del sarcomero, nel muscolo rilassato, l'actina viaggia all'inizio della banda H su ciascun lato.
Pertanto, nelle fibre muscolari del muscolo scheletrico rilassato i miofilamenti spessi occupano l'area centrale che forma le bande scure o A; ei sottili filamenti si estendono su entrambi i lati del sarcomero senza raggiungere il centro del sarcomero.
In una sezione trasversale nella regione in cui i filamenti spessi e sottili si sovrappongono, si può osservare un motivo esagonale che include il filamento spesso al centro e sei filamenti sottili che lo circondano e che si trovano in ciascuno dei bordi dell'esagono.
Questa organizzazione dei miofilamenti nel sarcomero è preservata dalla funzione di una serie di proteine associate ai miofilamenti e che hanno funzioni strutturali, tra cui si possono evidenziare titina, alfa actina, nebulina, miomesina e proteina C..
Meccanismo di contrazione
Quando l'acetilcolina (un neurotrasmettitore) viene rilasciata nella piastra neuromuscolare dalla stimolazione di un motoneurone, la fibra muscolare viene eccitata e i canali del calcio voltaggio-dipendenti del reticolo sarcoplasmatico si aprono.
Il calcio si lega alla troponina C e questo provoca un cambiamento conformazionale della tropomiosina, che espone i siti attivi dell'actina, iniziando così la contrazione. Quando i livelli di calcio diminuiscono, la tropomiosina ritorna alla sua posizione iniziale e la contrazione cessa..
L'esposizione dei siti di legame dell'actina alla miosina consente a entrambe le proteine di legarsi e alla miosina di spingere l'actina verso il centro del sarcomero, scivolando sulla miosina.
Durante la contrazione muscolare, le linee Z di ciascun sarcomero si avvicinano al centro, avvicinandosi alla linea M, aumentando l'interdigitazione tra actina e miosina e riducendo la dimensione delle bande I e H. Il grado di accorciamento dipenderà dalla somma dell'accorciamento di ciascuno dei sarcomeri del muscolo contratto.
Riferimenti
- Berna, R. e Levy, M. (1990). Fisiologia. Mosby; Edizione internazionale.
- Fox, S. I. (2006). Fisiologia umana (9 ° ed.). New York, USA: McGraw-Hill Press.
- Gartner, L. e Hiatt, J. (2002). Testo dell'Atlante Istologico (2a ed.). México D.F .: McGraw-Hill Interamericana Editores.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Biochimica illustrata di Harper (28 ° ed.). McGraw-Hill Medical.
- Rawn, J. D. (1998). Biochimica. Burlington, Massachusetts: Neil Patterson Publishers.
- Ross, M. e Pawlina, W. (2006). Istologia. Un testo e un atlante con la biologia cellulare e molecolare correlata (5a ed.). Lippincott Williams & Wilkins.
- West, J. (1998). Basi fisiologiche della pratica medica (12 ° ed.). México D.F .: Editorial Médica Panamericana.


Nessun utente ha ancora commentato questo articolo.