
Chiralità miscela racemica, esempi

UN miscela racemica o racemate è uno composto da due enantiomeri in parti uguali e che è quindi otticamente inattivo. Questa attività ottica si riferisce alla capacità delle sue soluzioni di ruotare, in senso orario o antiorario, un fascio di luce polarizzata che le attraversa in una direzione..
Un enantiomero ha la capacità di ruotare la luce polarizzata, diciamo, a sinistra (mancino), quindi la sua soluzione pura sarà otticamente attiva. Tuttavia, se inizia ad aggiungersi l'enantiomero che ruota la luce verso destra (destrogiro), la sua attività ottica diminuirà fino a quando non viene disattivato..

Quando ciò accade si dice che ci sono quantità uguali di enantiomeri sinistro e destro; Se una molecola ruota la luce polarizzata verso sinistra, il suo effetto verrà immediatamente annullato quando "inciampa" con un'altra molecola che la ruota verso destra. E così via. Pertanto, avremo una miscela racemica.
Il primo avvistamento di enantiomerismo fu fatto dal chimico francese Louis Pasteur nel 1848, che stava studiando una miscela di cristalli enantiomerici di acido tartarico (a quel tempo chiamato acido racemico). Poiché questo acido proveniva dalle uve utilizzate per fare i vini, questa miscela finì per essere applicata in modo generale per tutte le molecole.
Indice articolo
- 1 Scarpe e chiralità
- 2 esempi
- 2.1 Acido tartarico
- 2.2 Chinino
- 2.3 Talidomide
- 2.4 1,2-Epossipropano
- 2.5 1-feniletilammina
- 2.6 Commento finale
- 3 Riferimenti
Scarpe e chiralità
Prima di tutto, perché ci sia una miscela racemica, devono esserci due enantiomeri (di solito), il che implica che entrambe le molecole sono chirali e che le loro immagini speculari non sono sovrapponibili. Un paio di scarpe lo illustra perfettamente: non importa quanto cerchi di sovrapporre la scarpa sinistra a quella destra, non saranno mai in grado di adattarsi..
La scarpa destra, per dire, devia la luce polarizzata a sinistra; mentre la scarpa sinistra lo fa a destra. In una soluzione ipotetica in cui le scarpe sono le molecole, se ci sono solo scarpe dritte e chirali, questa sarà otticamente attiva. Lo stesso accadrà se rimarranno solo le scarpe in soluzione.
Tuttavia, se ci sono mille scarpe sinistre mischiate a mille scarpe destre, allora abbiamo una miscela racemica, anch'essa otticamente inattiva, poiché le deviazioni subite dalla luce interna si annullano a vicenda..
Se invece delle scarpe fossero palline, oggetti achirali, sarebbe impossibile che esistano miscele racemiche di queste, poiché non sarebbero nemmeno in grado di esistere come coppie di enantiomeri.
Esempi
Acido tartarico
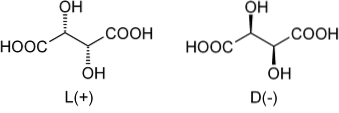
Tornando all'acido tartarico, la sua miscela racemica fu la prima ad essere conosciuta. Nell'immagine in alto sono mostrati i suoi due enantiomeri, ciascuno in grado di formare cristalli con facce morfologiche "sinistra" o "destra". Pasteur, attraverso l'aiuto di un microscopio e uno sforzo rigoroso, è riuscito a separare questi cristalli enantiomerici l'uno dall'altro..
I cristalli degli enantiomeri L (+) e D (-), separatamente, mostrano attività ottica deviando la luce polarizzata rispettivamente a destra oa sinistra. Se entrambi i cristalli in proporzioni molari uguali si dissolvono in acqua, si otterrà una miscela racemica otticamente inattiva..
Si noti che entrambi gli enantiomeri hanno due atomi di carbonio chirali (con quattro diversi sostituenti). In L (+), gli OH si trovano dietro il piano formato dallo scheletro di carbonio e dai gruppi COOH; mentre in D (-) questi OH sono sopra detto piano.
Coloro che sintetizzano l'acido tartarico otterranno una miscela racemica. Per separare l'enantiomero L (+) dal D (-), è necessaria una risoluzione chirale, in cui questa miscela viene fatta reagire con una base chirale per produrre sali diastereoisomerici, in grado di essere separati successivamente mediante cristallizzazione frazionata..
Chinino

Nell'esempio sopra, per riferirsi a una miscela racemica di acido tartarico è solitamente scritto come acido (±) -tartarico. Quindi, nel caso del chinino (immagine in alto) sarà (±) -kinine.
L'isomeria del chinino è complessa: ha quattro atomi di carbonio chirali, dando origine a sedici diastereoisomeri. È interessante notare che due dei suoi enantiomeri (uno con l'OH sopra il piano e l'altro sotto di esso), sono in realtà diastereoisomeri, poiché differiscono nelle configurazioni dei loro altri carboni chirali (quelli del biciclo con l'atomo di N).
Tuttavia, è difficile determinare quale degli stereoisomeri del chinino devierà la luce polarizzata a destra oa sinistra..
Talidomide
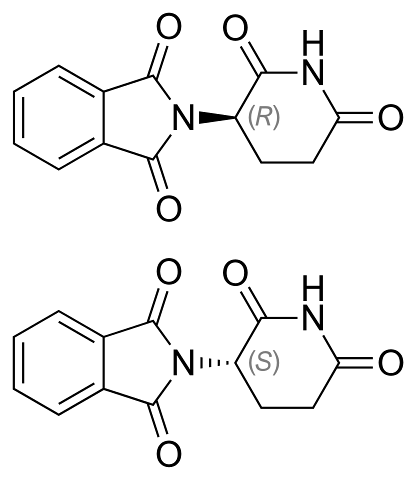
Gli enantiomeri della talidomide sono mostrati sopra. Ha un solo carbonio chirale: quello legato all'azoto che unisce entrambi gli anelli (uno di ftalimmide e l'altro di gluteramide).
Nell'enantiomero R (con proprietà sedative) l'anello ftalimmidico (quello a sinistra) è orientato al di sopra del piano; mentre nell'enantiomero S (con proprietà mutagene), di seguito.
Non è noto all'occhio percento quale dei due devia la luce a sinistra oa destra. Ciò che è noto è che una miscela 1: 1 o 50% di entrambi gli enantiomeri forma la miscela racemica (±) -talidomide.
Se si vuole commercializzare la talidomide solo come sedativo ipnotico, è obbligatorio sottoporre la sua miscela racemica alla risoluzione chirale già citata, in modo tale da ottenere l'enantiomero R puro..
1,2-Epossipropano
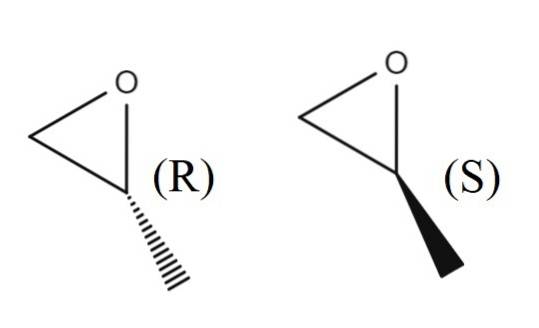
Nell'immagine in alto hai la coppia di enantiomeri di 1,2-epossipropano. L'enantiomero R devia la luce polarizzata a destra, mentre l'enantiomero S la devia a sinistra; cioè, il primo è (R) - (+) - 1,2-epossipropano, e il secondo è (S) - (-) - 1,2-epossipropano.
La miscela racemica dei due, ancora una volta, in un rapporto 1: 1 o 50%, diventa (±) -1,2-epossipropano.
1-feniletilammina
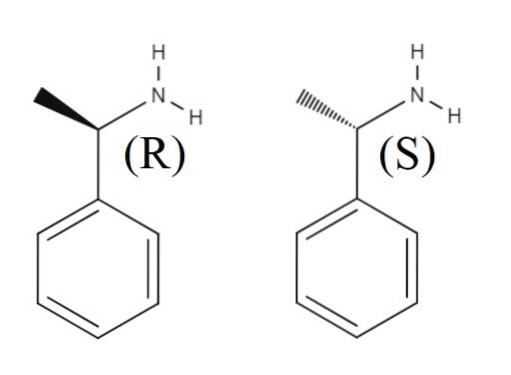
Sopra c'è un'altra miscela racemica formata dai due enantiomeri di 1-feniletilammina. L'enantiomero R è (R) - (+) - 1-feniletilammina e l'enantiomero S è (S) - (-) - 1-feniletilammina; uno ha il gruppo metile, CH3, puntando fuori dal piano dell'anello aromatico e l'altro puntando al di sotto di esso.
Si noti che quando la configurazione è R, a volte coincide con il fatto che l'enantiomero ruota la luce polarizzata verso destra; tuttavia, non sempre si applica e non può essere considerata una regola generale.
Commento finale
Più importante dell'esistenza o meno di miscele racemiche è la loro risoluzione chirale. Ciò vale soprattutto per i composti con effetti farmacologici che dipendono da detto stereoisomerismo; cioè, un enantiomero può essere benefico per il paziente, mentre l'altro può influenzarlo.
Questo è il motivo per cui queste risoluzioni chirali vengono utilizzate per separare le miscele racemiche nei loro componenti e quindi essere in grado di commercializzarle come farmaci puri privi di impurità nocive..
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Steven A. Hardinger. (2017). Glossario illustrato di chimica organica: miscela racemica. Dipartimento di Chimica e Biochimica, UCLA. Estratto da: chem.ucla.edu
- Nancy Devino. (2019). Miscela racemica: definizione ed esempio. Studia. Estratto da: study.com
- James Ashenhurst. (2019). Stereochimica e chiralità: che cos'è una miscela racemica? Estratto da: masterorganicchemistry.com
- John C. Leffingwell. (2003). Chiralità e bioattività I .: Farmacologia. [PDF]. Estratto da: leffingwell.com



Nessun utente ha ancora commentato questo articolo.