
Pioggia acida come si forma, composizione, reazioni ed effetti

Il pioggia acida È la precipitazione umida o secca di sostanze che generano un pH inferiore a 5,6. Questa precipitazione può essere umida (diluita in acqua piovana) o secca (deposizioni di particelle o aerosol).
Il termine "pioggia acida" fu proposto per la prima volta dal ricercatore inglese Robert Angus Smith nel 1850, nel mezzo della rivoluzione industriale. Gli acidi più abbondanti che si formano nell'atmosfera sono nitrici e solforici per ossidazione di inquinanti naturali o artificiali..
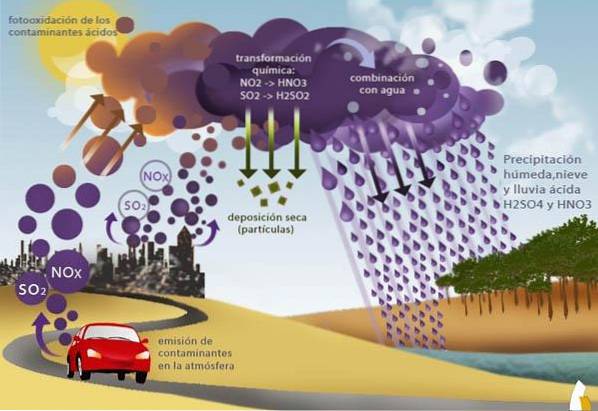
Gli inquinanti più rilevanti sono gli ossidi: NO2, NO3, SO2, le cui fonti naturali sono le eruzioni vulcaniche, gli incendi boschivi e la degradazione batterica. Le fonti artificiali sono le emissioni di gas derivanti dalla combustione di combustibili fossili (attività industriale e traffico automobilistico).
Le piogge acide provocano impatti negativi sull'ambiente come l'acidificazione del suolo e delle acque, colpendo gli esseri viventi, compreso l'uomo. Allo stesso modo, il suolo e l'acqua sono contaminati da metalli pesanti e nei corpi idrici si verifica l'eutrofizzazione..
A livello della vegetazione, si verificano danni diretti alle foglie e la crescita delle piante ne risente. Inoltre, l'acidificazione del suolo immobilizza i nutrienti e colpisce le micorrize (funghi del suolo). Allo stesso modo, edifici, macchinari, monumenti e opere d'arte esposti alle intemperie sono seriamente ossidati o erosi dall'effetto degli acidi precipitati..
Per ovviare all'effetto delle piogge acide si possono adottare alcune misure essenziali come la protezione dei monumenti e la correzione dell'acidificazione dei suoli e delle acque. Tuttavia, la soluzione di base per le piogge acide è ridurre l'emissione in atmosfera di composti chimici precursori della formazione di acidi..
Indice articolo
- 1 Come si forma la pioggia acida?
- 1.1 Precursori chimici
- 1.2 Processo troposferico e acidi prodotti
- 1.3 Precipitazioni
- 2 Composizione
- 3 Reazioni chimiche della pioggia acida
- 3.1 Formazione di acido solforico (H2SO4)
- 3.2 Formazione di acido nitrico (HNO3)
- 4 Effetti sull'ambiente
- 4.1 Acidificazione del suolo e suoi effetti sulla vegetazione
- 4.2 Effetto sulle falde acquifere e sulla salute umana
- 4.3 Deterioramento di edifici, monumenti e materiali
- 5 Flora e fauna
- 5.1 Piante e animali in corpi idrici lentici
- 5.2 Vegetazione e disponibilità di nutrienti
- 5.3 Danni diretti a piante e animali
- 6 Soluzioni
- 6.1 Ridurre le emissioni
- 6.2 Applicare misure di correzione dell'acidità
- 6.3 Protezione superficiale
- 7 Riferimenti
Come si forma la pioggia acida?

Agenti precursori chimici
Il fenomeno delle piogge acide inizia con l'emissione in atmosfera di composti chimici precursori della formazione di acidi. Questi composti possono essere emessi da fonti naturali o artificiali.
Le fonti naturali includono eruzioni vulcaniche, incendi di vegetazione ed emissioni oceaniche. Come fonti artificiali agiscono le emissioni industriali, le emissioni dei veicoli a motore a combustione o la combustione dei rifiuti.
Queste fonti emettono vari composti che possono generare acidi nell'atmosfera. Tuttavia, i più importanti sono gli ossidi di azoto e gli ossidi di zolfo.
Gli ossidi di azoto sono noti come NOx e includono biossido di azoto (NO2) e protossido di azoto (NO). Da parte sua, l'ossido di zolfo è SO2 o anidride solforosa.
Processo troposferico e acidi prodotti
Il fenomeno delle piogge acide si verifica nella troposfera (zona atmosferica che va dalla superficie terrestre ad un'altezza di 16 km).
Nella troposfera, le correnti d'aria possono trasportare questi composti su qualsiasi parte del pianeta, rendendolo un problema globale. In questo processo, gli ossidi di azoto e di zolfo interagiscono con altri composti per formare rispettivamente acido nitrico e acido solforico..
Supporto alla reazione
Le reazioni chimiche possono essere condotte sia su particelle solide in sospensione che in gocce d'acqua in sospensione..
L'acido nitrico si forma principalmente nella fase gassosa, a causa della sua bassa solubilità in acqua. Da parte sua, l'acido solforico è più solubile in acqua, essendo il costituente principale delle piogge acide.
L'acido nitrico
Per la formazione di acido nitrico (HNO3), gli ossidi di azoto reagiscono con l'acqua, con radicali come OH (in misura minore con HO2 e CH3O2), o con ozono troposferico (O3).
Acido solforico
Nel caso della produzione di acido solforico (H2SO4) partecipano anche i radicali OH, HO2, CH3O2, acqua e ozono. Inoltre, può essere formato reagendo con perossido di idrogeno (H2O2) e vari ossidi metallici..
Acido carbonico
L'H2CO3 si forma grazie alla reazione fotochimica dell'anidride carbonica con l'acqua atmosferica.
Acido cloridrico
HCl rappresenta solo il 2% delle piogge acide e il suo precursore è il cloruro di metile (ClCH3). Questo composto proviene dagli oceani ed è ossidato dai radicali OH per formare acido cloridrico..
Precipitazione
Una volta formati i composti acidi (acido nitrico o acido solforico e, in misura minore, acido cloridrico), precipiteranno.
La precipitazione può avvenire mediante deposizione delle particelle sospese in cui ha avuto luogo la reazione di acidificazione in fase gassosa. Un altro modo è che sotto la pioggia l'acqua condensata dove si sono formati gli acidi precipita.
Composizione
L'acidità naturale delle piogge si avvicina ad un pH di 5,6, sebbene in alcune zone incontaminate valori di 5. Questi bassi valori di pH sono stati associati alla presenza di acidi di origine naturale..
Si ritiene che, a seconda del livello di pH, la pioggia possa essere classificata in:
a) Leggermente acido (pH compreso tra 4,7 e 5,6)
b) Acido medio (pH compreso tra 4,3 e 4,7)
c) Fortemente acido (pH inferiore o uguale a 4,3).
Se la pioggia ha una concentrazione> 1,3 mg / L di nitrati e> 3 mg / L nel caso di solfati, la contaminazione è considerata elevata.
La pioggia acida è composta in più di due terzi dei casi dalla presenza di acido solforico, seguito in abbondanza dall'acido nitrico. Altri componenti che possono contribuire all'acidità della pioggia sono l'acido cloridrico e l'acido carbonico..
Reazioni chimiche della pioggia acida
Formazione di acido solforico (H2SO4)
La produzione di acido solforico può avvenire in fase gassosa o in fase liquida.
Fase gassosa
Solo il 3-4% di SO2 viene ossidato in fase gassosa per produrre acido solforico. Esistono molte vie per la formazione di acido solforico da precursori gassosi, qui viene mostrata la reazione di SO2 con ozono troposferico.
La reazione avviene in due fasi:
1.- L'anidride solforosa reagisce con l'ozono troposferico generando anidride solforosa e rilasciando ossigeno.
SO2 + O3 = SO3 + O2
2.- Quindi il triossido di zolfo viene ossidato con vapore acqueo e produce acido solforico.
SO3 + H2O = H2SO4
Fase liquida
Nelle gocce d'acqua che formeranno la pioggia, l'acido solforico può essere prodotto in diversi modi:
1.- SO2 si dissolve in acqua generando acido solforoso, e questo viene ossidato dal perossido di idrogeno:
SO2 + H2O = H2SO2
H2SO2 + H2O2 = H2SO4 + H2O
2.- Meccanismo fotocatalitico: in questo caso particelle di ossido di metallo (ferro, zinco, titanio) si attivano grazie all'azione della luce solare (attivazione fotochimica) e ossidano SO2 generando acido solforico.
Formazione di acido nitrico (HNO3)
L'ozono troposferico O3 produce la trasformazione di NO2 in HNO3 in un processo a tre fasi:
1.- NO2 + O3 = NO3 + O2
2.- NO3 + NO2 = N2O5
3.- N2O5 + H2O = 2HNO3
Effetti sull'ambiente

Acidificazione del suolo e suoi effetti sulla vegetazione
L'effetto delle piogge acide sul suolo varia a seconda della sua composizione. Ad esempio, i terreni di origine calcarea, basaltica e ignea hanno una maggiore capacità di neutralizzare l'acidità..
Da parte loro, i terreni ricchi di quarzo come materiale inerte non sono in grado di regolare il contenuto di acido. Pertanto, nei terreni in cui la pioggia acida aumenta l'acidità, gli ioni metallici che sono tossici per piante e animali vengono rilasciati e portati via..
Un caso rilevante è la dissoluzione degli alluminosilicati, che rilasciano ioni di alluminio molto dannosi per la vegetazione..
In generale, l'acidità del suolo riduce la disponibilità di nutrienti per le piante. Inoltre, favorisce il rilascio e il lavaggio del calcio, che causa carenze nelle piante.
Effetto sulle falde acquifere e sulla salute umana
Nella maggior parte dei casi, la pioggia acida non ha un aspetto o un sapore diverso dalla pioggia normale, né genera sensazioni sulla pelle. I suoi effetti sulla salute umana sono indiretti e raramente causa danni alla pelle a causa dell'estrema acidità..
Uno dei problemi con le piogge acide è che abbassando i valori di pH al di sotto di 5, i metalli pesanti vengono rilasciati e portati via. Questi inquinanti come l'alluminio e il cadmio possono entrare nelle falde acquifere sotterranee.
Se l'acqua di queste falde acquifere contaminate passa in pozzi utilizzati per il consumo umano, può causare gravi danni alla salute.
Deterioramento di edifici, monumenti e materiali

Pietre di tipo calcareo
Costruzioni, monumenti e sculture in pietra calcarea o marmo sono gravemente colpiti dalle piogge acide. Questo è abbastanza serio, poiché molti edifici storici e opere d'arte sono costruiti con questi materiali..
Nel caso del calcare, la pioggia acida provoca la dissoluzione del calcare e provoca la ricristallizzazione della calcite. Questa ricristallizzazione produce toni biancastri sulla superficie..
Nel caso specifico delle piogge con acido solforico si verifica il fenomeno della solfatazione. Attraverso questo processo, la superficie della roccia viene trasformata in gesso e viene rilasciata CO2..
Il marmo, sebbene più resistente, risente anche delle piogge acide. In questo caso si verifica l'esfoliazione della pietra, motivo per cui gli strati superficiali di essa si staccano.
Altri materiali non corrosivi
In alcuni edifici il deterioramento strutturale è minore, ma anche con effetti negativi. Ad esempio, i depositi di acido secco sporcano le pareti, aumentando i costi di manutenzione.
Metalli
La pioggia acida provoca la corrosione dei metalli a causa del fenomeno dell'ossidazione. Ciò provoca enormi perdite economiche, poiché strutture, attrezzature, macchinari e veicoli con parti metalliche sono gravemente colpiti..
flora e fauna

La pioggia acida modifica l'equilibrio naturale degli ecosistemi acquatici e terrestri.
Piante e animali in specchi d'acqua lentici
I corpi idrici lentici sono più suscettibili all'acidificazione, perché sono ecosistemi chiusi. Inoltre, l'accumulo di acidi nell'acqua ha conseguenze negative sulla vita che ospita..
Un'altra conseguenza dell'acidificazione è la precipitazione dei nitrati attraverso la pioggia, che provoca l'eutrofizzazione nei corpi idrici. I nutrienti in eccesso riducono l'ossigeno disponibile e influenzano negativamente la sopravvivenza degli animali acquatici.
Un altro effetto negativo indiretto è il trascinamento di ioni di metalli pesanti dall'ambiente terrestre nei corpi idrici. Questi ioni vengono rilasciati nel terreno dall'azione degli ioni idronio quando l'acidità aumenta..
Vegetazione e disponibilità di nutrienti
I problemi più gravi causati dall'acidificazione del suolo sono l'immobilità dei nutrienti essenziali e l'aumento dei metalli tossici..
Ad esempio, l'alluminio e il magnesio vengono rilasciati dalle particelle del suolo per essere sostituiti dall'idrogeno. L'alluminio influenza la struttura e la funzione delle radici e riduce l'assorbimento del calcio essenziale per le piante.
D'altra parte, l'acidificazione del suolo provoca danni alle micorrize (funghi associati alle radici), che sono essenziali nella dinamica del bosco..
Danni diretti a piante e animali
L'acido solforico provoca danni diretti alle foglie degradando la clorofilla e producendo clorosi (ingiallimento della foglia). In alcune specie la crescita e la produzione di semi vitali diminuiscono.
Gli anfibi (rane e rospi) sono particolarmente sensibili agli effetti dell'acidità dell'acqua. Alcuni danni sono lesioni dirette e diminuzione della difesa contro i patogeni (in particolare i funghi della pelle).
Soluzioni
Riduci le emissioni
Il risultato finale per le piogge acide è ridurre il rilascio nell'ambiente di prodotti chimici precursori di acidi. I più importanti di questi sono gli ossidi di zolfo e di azoto.
Tuttavia, ciò presenta alcune difficoltà, poiché implica influire sugli interessi economici e di sviluppo di aziende e paesi. Ad esempio, una delle principali fonti di anidride solforosa è la combustione del carbone, che rappresenta oltre il 70% dell'energia in Cina..
Esistono alcune alternative tecnologiche che possono aiutare a ridurre le emissioni. Ad esempio, nell'industria i cosiddetti "letti fluidizzati" incorporano assorbenti (calcare o dolomite) che trattengono SO2. Nel caso dei veicoli a motore e dei motori a combustione in generale, anche i convertitori catalitici contribuiscono a ridurre le emissioni di SO2.
D'altra parte, alcuni paesi hanno implementato programmi specifici di riduzione delle piogge acide. Ad esempio, gli Stati Uniti hanno sviluppato il National Acid Precipitation Assessment Program (NAPAP). Tra alcune delle misure previste dal NAPAP c'è l'implementazione dell'uso di combustibili a basso tenore di zolfo.
Un'altra possibile misura è la sostituzione della flotta con auto elettriche per ridurre sia le piogge acide che il riscaldamento globale. Tuttavia, sebbene esista la tecnologia per raggiungere questo obiettivo, la pressione delle industrie automobilistiche e petrolifere ha ritardato le decisioni al riguardo. Altri fattori che influenzano sono gli elementi culturali legati alla velocità che un veicolo aspira a raggiungere..
Applicare misure di correzione dell'acidità
In alcuni casi, il pH del suolo e delle acque può essere aumentato aggiungendo alcali, ad esempio incorporando grandi quantità di calce. Tuttavia, questa pratica non è realizzabile in aree molto estese..
Protezione delle superfici
Pietra
Esistono vari metodi per proteggere o almeno ridurre il deterioramento della pietra sotto l'effetto delle piogge acide. Uno di questi metodi è lavarlo con vapore o acqua calda..
Possono essere utilizzati anche agenti chimici come acido fluoridrico o bifluoruro di ammonio. Una volta lavata, la pietra può essere sigillata applicando prodotti speciali che ostruiscono i pori, come l'idrossido di bario.
Metallo
Le superfici metalliche corrose possono essere protette rivestendo con un metallo non corrosivo come lo zinco..
Per questo può essere applicata l'elettrodeposizione, oppure la struttura metallica da proteggere può essere immersa nel metallo protettivo allo stato liquido..
Riferimenti
- Espada L e A. Sánchez (1995). Influenza delle piogge acide sulla corrosione dei metalli. pp. 145-171. In: Sastre de Vicente M. (Coord.) Elettrochimica e ambiente alle soglie del XXI secolo. Università di La Coruña. Servizio pubblicazioni. La Coruña, Spagna.
- García-Ruiz G (2018). Protezione delle strutture edilizie in atmosfere corrosive. Progetto di fine laurea in Ingegneria delle tecnologie industriali. Politecnico di Cartagena. Scuola Tecnica Superiore di Ingegneria Industriale. Cartagena, Spagna. 75 p.
- Granados-Sánchez D, GF López-Ríos e MA Hernández-García (2010). Pioggia acida e ecosistemi forestali… Chapingo Magazine Scienze forestali e ambientali Serie 16: 187-206.
- Come GE, CT Driscoll e DC Buso (1996). Effetti a lungo termine della pioggia acida: risposta e recupero di un ecosistema forestale. Science, 272; 244-246.
Come GE e FH Bormann (1974). Pioggia acida: un grave problema ambientale regionale. Science, 184: 1176-1179. - Schindler DW (1988). Effetti della pioggia acida sugli ecosistemi di acqua dolce. Science, 239: 149-157.
- Vélez-Upegui JJ, MC Valencia-Giraldo, A Londoño-Carvajal, CM González-Duque, JP Mariscal-Moreno (2010). Inquinamento atmosferico e piogge acide. Diagnosi del fenomeno nella città di Manizales. Facoltà di Ingegneria e Architettura. Università nazionale della Colombia. Sede di Manizales. Editoriale Blanecolor Ltda. Prima edizione. Manizales, Colombia. 150 p.


Nessun utente ha ancora commentato questo articolo.