
Formule e unità di Charles Law, esperimenti, esercizi
Il Charles Law o Guy-Lussac è quello che permette di enunciare una delle proprietà dello stato gassoso: il volume che un gas occupa è direttamente proporzionale alla temperatura a pressione costante.
Questa proporzionalità è lineare per tutti gli intervalli di temperatura se il gas in questione è l'ideale; i gas reali, invece, deviano dall'andamento lineare a temperature prossime al loro punto di rugiada. Tuttavia, ciò non ha limitato l'uso di questa legge per una miriade di applicazioni che coinvolgono i gas..

Una delle applicazioni per eccellenza della legge di Charles è nei palloni ad aria. Altri palloncini più semplici, come quelli dei desideri, chiamati anche lanterne cinesi (immagine in alto), rivelano la relazione tra il volume e la temperatura di un gas a pressione costante.
Perché a pressione costante? Perché se la pressione aumentasse, significherebbe che il contenitore dove si trova il gas è chiuso ermeticamente; e con ciò aumenterebbero le collisioni o gli impatti delle particelle gassose contro le pareti interne di detto contenitore (legge di Boyle-Mariotte).
Pertanto, non ci sarebbe alcun cambiamento nel volume occupato dal gas e mancherebbe la legge di Charles. A differenza di un contenitore ermetico, il tessuto dei palloncini dei desideri rappresenta una barriera mobile, in grado di espandersi o contrarsi a seconda della pressione esercitata dal gas al suo interno..
Tuttavia, man mano che il tessuto dei palloncini si espande, la pressione interna del gas rimane costante perché l'area su cui le sue particelle si scontrano aumenta. Maggiore è la temperatura del gas, maggiore è l'energia cinetica delle particelle e quindi il numero di collisioni.
E mentre il pallone si espande di nuovo, le collisioni contro le sue pareti interne rimangono (idealmente) costanti..
Quindi più caldo è il gas, maggiore è l'espansione del palloncino e più in alto salirà. Il risultato: luci rossastre (anche se pericolose) sospese nel cielo nelle notti di dicembre..
Indice articolo
- 1 Qual è la legge di Charles?
- 1.1 Dichiarazione
- 1.2 Lavori
- 1.3 Grafico
- 2 Formule e unità di misura
- 2.1 Formule
- 2.2 Unità
- 3 Esperimento per dimostrare la legge
- 3.1 Montaggio
- 3.2 Sviluppo
- 3.3 Palloncino con ghiaccio in inverno
- 4 Esercizi risolti
- 4.1 Esercizio 1
- 4.2 Esercizio 2
- 4.3 Esercizio 3
- 5 Applicazioni
- 5.1 Palloncini di auguri
- 5.2 Termometri pop-up o tacchino
- 5.3 Ripristino della forma delle palline da ping-pong
- 5.4 Preparazione del pane
- 6 Riferimenti
Qual è la legge di Charles?
Dichiarazione
La cosiddetta Legge di Charles o Legge di Gay-Lussac spiega la dipendenza che esiste tra il volume occupato da un gas e il valore della sua temperatura assoluta o temperatura Kelvin..
La Legge si può affermare come segue: se la pressione rimane costante, ne consegue che “per una data massa di un gas, aumenta il suo volume di circa 1/273 volte il suo volume a 0 ºC, per ogni grado centigrado (1 ºC) per aumentare la sua temperatura ".
Lavori
Il lavoro di ricerca che ha stabilito la legge è stato avviato negli anni 1780 da Jacques Alexander Cesar Charles (1746-1823). Tuttavia, Charles non ha pubblicato i risultati della sua ricerca..
Successivamente, John Dalton nel 1801 riuscì a determinare sperimentalmente che tutti i gas e i vapori, da lui studiati, si espandono tra due temperature determinate nella stessa quantità di volume. Questi risultati furono confermati da Gay-Lussac nell'anno 1802.
I lavori di ricerca di Charles, Dalton e Gay-Lussac, hanno permesso di stabilire che il volume occupato da un gas e la sua temperatura assoluta sono direttamente proporzionali. Pertanto, esiste una relazione lineare tra la temperatura e il volume di un gas.
Grafico
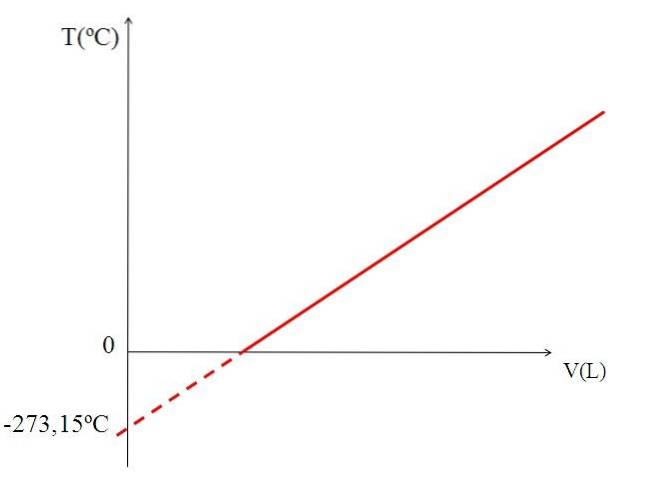
Rappresentando graficamente (immagine in alto) il volume di un gas rispetto alla temperatura produce una linea retta. L'intersezione della linea con l'asse X, alla temperatura di 0 ºC, permette di ottenere il volume del gas a 0 ºC.
Allo stesso modo, l'intersezione della linea con l'asse X darebbe informazioni sulla temperatura per la quale il volume occupato dal gas sarebbe zero "0". Dalton ha stimato questo valore a -266 ºC, vicino al valore suggerito da Kelvin per lo zero assoluto (0).
Kelvin ha proposto una scala di temperatura il cui zero dovrebbe essere la temperatura alla quale un gas perfetto avrebbe un volume pari a zero. Ma a queste basse temperature i gas vengono liquefatti.
Ecco perché non è possibile parlare di volumi di gas in quanto tali, trovando che il valore per lo zero assoluto dovrebbe essere -273,15 ºC.
Formule e unità di misura
Formule
La legge di Charles nella sua versione moderna afferma che il volume e la temperatura di un gas sono direttamente proporzionali.
Poi:
V / T = k
V = volume di gas. T = temperatura Kelvin (K). k = costante di proporzionalità.
Per un volume V1 e una temperatura T1
k = V1 / T1
Allo stesso modo, per un volume VDue e una temperatura TDue
k = VDue / TDue
Quindi, equiparando le due equazioni per k abbiamo
V1 / T1 = VDue / TDue
Questa formula può essere scritta come segue:
V1 TDue = VDue T1
Risolvendo per VDue, ottieni la formula:
VDue = V1 TDue / T1
Unità
Il volume del gas può essere espresso in litri o in una qualsiasi delle sue unità derivate. Allo stesso modo, il volume può essere espresso in metri cubi o in una qualsiasi unità derivata. La temperatura deve essere espressa in temperatura assoluta o temperatura Kelvin.
Quindi, se le temperature di un gas sono espresse in gradi centigradi o in scala Celsius, per eseguire un calcolo con esse, bisognerebbe aggiungere la quantità di 273,15 ºC alle temperature, in modo da portarle a temperature assolute o kelvin..
Se le temperature sono espresse in gradi Fahrenheit, sarebbe necessario aggiungere 459,67 ºR a quelle temperature, per portarle a temperature assolute sulla scala Rankine..
Un'altra formula ben nota della Legge di Charles, e direttamente correlata alla sua affermazione, è la seguente:
Vt = Vo (1 + t / 273)
Dove Vt è il volume occupato da un gas a una certa temperatura, espresso in litri, cm3, eccetera.; e Vo è il volume occupato da un gas a 0 ºC. Da parte sua, t è la temperatura alla quale viene misurato il volume, espressa in gradi centigradi (ºC).
Infine, 273 rappresenta il valore dello zero assoluto sulla scala della temperatura Kelvin.
Esperimento per dimostrare la legge
Montaggio
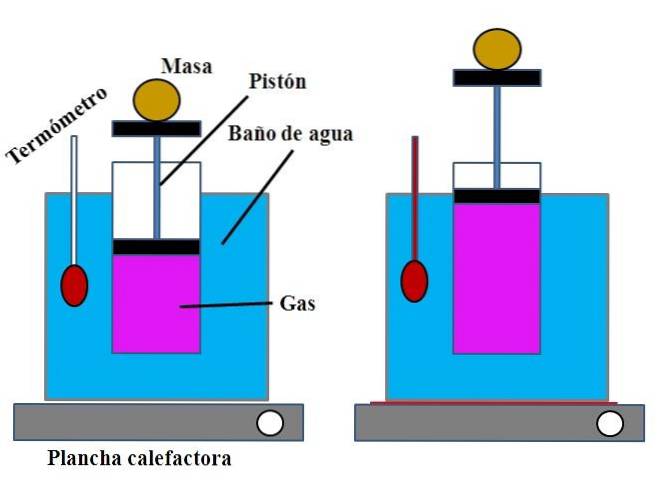
In un contenitore d'acqua, che svolgeva la funzione di bagnomaria, era posto in alto un cilindro aperto, con uno stantuffo che si adattava alla parete interna del cilindro (immagine in alto).
Questo pistone (costituito dal pistone e dalle due basi nere) potrebbe spostarsi verso la parte superiore o inferiore del cilindro a seconda del volume di gas in esso contenuto..
Il riscaldamento del bagnomaria poteva essere effettuato utilizzando un bruciatore o un impianto di riscaldamento, che fornisse il calore necessario per aumentare la temperatura del bagno e quindi la temperatura del bollitore dotato di pistone..
Una determinata massa è stata posta sullo stantuffo per garantire che l'esperimento fosse condotto a pressione costante. La temperatura del bagno e del cilindro è stata misurata utilizzando un termometro posto nel bagnomaria..
Sebbene il cilindro probabilmente non avesse una graduazione per visualizzare il volume d'aria, questa poteva essere stimata misurando l'altezza raggiunta dalla massa posta sul pistone e la superficie della base del cilindro..
Sviluppando
Il volume di un cilindro si ottiene moltiplicando la superficie della sua base per la sua altezza. La superficie della base del cilindro può essere ottenuta applicando la formula: S = Pi x rDue.
Mentre l'altezza si ottiene misurando la distanza dalla base del cilindro, alla parte del pistone su cui poggia la massa.
Man mano che la temperatura del bagno veniva aumentata dal calore prodotto dall'accendino, si osservava che lo stantuffo aumentava all'interno del cilindro. Quindi, leggono sul termometro la temperatura nel bagnomaria, che corrispondeva alla temperatura all'interno del cilindro..
Allo stesso modo, hanno misurato l'altezza della massa sopra lo stantuffo, potendo stimare il volume d'aria che corrispondeva alla temperatura misurata. In questo modo, hanno effettuato diverse misurazioni della temperatura e stime del volume d'aria corrispondente a ciascuna delle temperature..
Con ciò è stato finalmente possibile stabilire che il volume che un gas occupa è direttamente proporzionale alla sua temperatura. Questa conclusione ha permesso di enunciare la cosiddetta Legge di Carlo.
Palloncino con ghiaccio in inverno
Oltre all'esperimento precedente, ce n'è uno più semplice e qualitativo: quello della mongolfiera con ghiaccio in inverno..
Se un pallone riempito di elio fosse posto in una stanza riscaldata in inverno, il pallone avrebbe un certo volume; Ma, se successivamente fosse spostato all'esterno della casa con una bassa temperatura, si osserverebbe che il pallone ad elio si restringe, riducendo il suo volume secondo la legge di Charles.
Esercizi risolti
Esercizio 1
C'è un gas che occupa un volume di 750 cm3 a 25 ºC: quale sarà il volume che questo gas occupa a 37 ºC se la pressione viene mantenuta costante?
È necessario prima trasformare le unità di temperatura in kelvin:
T1 in gradi Kelvin = 25 ºC + 273,15 ºC = 298,15 K
TDue in gradi Kelvin = 37 ºC + 273,15 ºC = 310,15 K
Perché V1 e le altre variabili, risolviamo per VDue ed è calcolato con la seguente equazione:
VDue = V1 · (TDue / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Esercizio 2
Quale sarebbe la temperatura in gradi Celsius alla quale dovrebbero essere riscaldati 3 litri di un gas a 32 ºC, in modo che il suo volume si espanda a 3,2 litri?
Ancora una volta, i gradi centigradi vengono trasformati in kelvin:
T1 = 32 ºC + 273,15 ºC = 305,15 K
E come nell'esercizio precedente, T è cancellatoDue invece di VDue, ed è calcolato di seguito:
TDue = VDue · (T1 / V1)
= 3,2 L · (305,15 K / 3 L)
= 325,49 K
Ma l'affermazione richiede gradi centigradi, quindi l'unità di T viene modificataDue:
TDue in gradi centigradi = 325, 49 º C (K) - 273,15 ºC (K)
= 52,34 ºC
Esercizio 3
Se un gas a 0 ºC occupa un volume di 50 cm3, Che volume occuperà a 45 ºC?
Usando la formula originale della legge di Charles:
Vt = Vo (1 + t / 273)
Procediamo per calcolare Vt direttamente in quanto sono disponibili tutte le variabili:
Vt = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (K))
= 58,24 cm3
D'altra parte, se il problema viene risolto utilizzando la strategia degli esempi 1 e 2, avremo:
VDue = V1 · (TDue / T1)
= 318 K · (50 cm3 / 273 K)
= 58,24 cm3
Il risultato, applicando le due procedure, è lo stesso perché in definitiva si basano sullo stesso principio della legge di Charles.
Applicazioni
Desideri palloncini
I palloncini wish (già citati nell'introduzione) sono dotati di un materiale tessile impregnato di un liquido combustibile.
Quando questo materiale viene incendiato, si verifica un aumento della temperatura dell'aria contenuta nel pallone, che provoca un aumento del volume del gas secondo la legge di Charles..
Pertanto, aumentando il volume d'aria nel pallone, la densità dell'aria in esso diminuisce, che diventa inferiore alla densità dell'aria circostante, ed è per questo che il pallone si alza.
Termometri pop-up o tacchino
Come indica il nome, vengono utilizzati durante la cottura dei tacchini. Il termometro ha un contenitore pieno d'aria chiuso con un coperchio ed è tarato in modo tale che quando viene raggiunta la temperatura di cottura ottimale, il coperchio si solleva emettendo un suono..
Il termometro viene posto all'interno del tacchino, e all'aumentare della temperatura all'interno del forno, l'aria all'interno del termometro si espande aumentando il suo volume. Quindi, quando il volume dell'aria raggiunge un certo valore, sollevare il coperchio del termometro.
Ripristinare la forma delle palline da ping-pong
A seconda delle esigenze di utilizzo, le palline da ping pong sono leggere e le loro pareti di plastica sono sottili. Ciò fa sì che quando vengono colpiti dalle racchette subiscano deformazioni.
Immergendo le sfere deformate in acqua calda, l'aria all'interno si riscalda e si espande, determinando un aumento del volume d'aria. Ciò provoca anche l'allungamento del muro delle palline da ping-pong, consentendo loro di tornare alla loro forma originale..
Fare il pane
I lieviti sono incorporati nella farina di frumento usata per fare il pane e hanno la capacità di produrre anidride carbonica..
All'aumentare della temperatura delle pagnotte durante la cottura, aumenta il volume di anidride carbonica. È per questo che il pane si espande fino a raggiungere il volume desiderato..
Riferimenti
- Clark J. (2013). Altre leggi sui gas - Legge di Boyle e Legge di Charles. Estratto da: chemguide.co.uk
- Staroscik Andrew. (2018). Legge di Charles. Estratto da: scienceprimer.com
- Wikipedia. (2019). Charles Law. Estratto da: en.wikipedia.org
- Helmenstine, Todd. (27 dicembre 2018). Qual è la formula per la legge di Charles? Estratto da: thoughtco.com
- Prof. N. De Leon. (s.f.). Leggi elementari dei gas: Charles Law. Note di classe C 101. Recupero da: iun.edu
- Briceño Gabriela. (2018). Charles Law. Estratto da: euston96.com
- Morris, J. G. (1974). Fisicochimica per biologi. (Duedà edizione). Editoriale Reverté, S.A.



Nessun utente ha ancora commentato questo articolo.