
Henry's Law Equation, Deviation, Applications
Il legge di Henry afferma che a temperatura costante, la quantità di gas disciolto in un liquido è direttamente proporzionale alla sua pressione parziale sulla superficie del liquido.
Fu postulato nel 1803 dal fisico e chimico inglese William Henry. La sua legge può anche essere interpretata in questo modo: se si aumenta la pressione sul liquido, maggiore sarà la quantità di gas disciolto in esso..

Qui il gas è considerato come il soluto della soluzione. A differenza del soluto solido, la temperatura ha un effetto negativo sulla sua solubilità. Pertanto, all'aumentare della temperatura, il gas tende a fuoriuscire più facilmente dal liquido verso la superficie..
Questo perché l'aumento della temperatura fornisce energia alle molecole gassose, che si scontrano tra loro per formare bolle (immagine in alto). Queste bolle quindi superano la pressione esterna e fuoriescono dal seno del liquido..
Se la pressione esterna è molto alta e il liquido viene mantenuto freddo, le bolle si dissolveranno e solo poche molecole gassose "aleggeranno" sulla superficie.
Indice articolo
- 1 Equazione della legge di Henry
- 2 Deviazione
- 3 Solubilità di un gas nel liquido
- 3.1 Insaturi
- 3.2 saturo
- 3.3 sovrasaturato
- 4 Applicazioni
- 5 esempi
- 6 Riferimenti
Equazione della legge di Henry
Può essere espresso dalla seguente equazione:
P = KH∙ C
Dove P è la pressione parziale del gas disciolto; C è la concentrazione di gas; e KH è la costante di Henry.
È necessario capire che la pressione parziale di un gas è quella esercitata individualmente da una specie del resto della miscela di gas totale. E la pressione totale non è altro che la somma di tutte le pressioni parziali (legge di Dalton):
PTotale= P1 + PDue + P3+... + Pn
Il numero di specie gassose che compongono la miscela è rappresentato da n. Ad esempio, se sulla superficie di un liquido sono presenti vapore acqueo e CODue, n è uguale a 2.
Deviazione
Per i gas scarsamente solubili nei liquidi, la soluzione è vicina all'ideale, rispettando la legge di Henry per il soluto.
Tuttavia, quando la pressione è alta, c'è una deviazione rispetto a Henry, perché la soluzione smette di comportarsi come un diluito ideale.
Cosa significa? Quelle interazioni soluto-soluto e soluto-solvente iniziano ad avere i loro effetti. Quando la soluzione è molto diluita, le molecole di gas vengono “esclusivamente” circondate da solvente, trascurando i possibili incontri tra loro..
Pertanto, quando la soluzione non è più idealmente diluita, la perdita di comportamento lineare si osserva nel grafico P.io contro Xio.
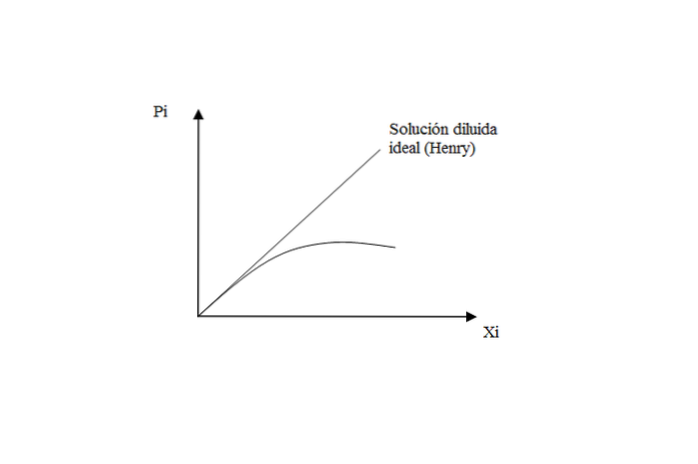
In conclusione a questo aspetto: la legge di Henry determina la tensione di vapore di un soluto in una soluzione diluita ideale. Mentre per il solvente si applica la legge di Raoult:
PPER = XPER∙ PPER*
Solubilità di un gas nel liquido

Quando un gas è ben disciolto in un liquido, come lo zucchero in acqua, non può essere distinto dall'ambiente, formando così una soluzione omogenea. In altre parole: non si osservano bolle nel liquido (o cristalli di zucchero).
Tuttavia, l'efficiente solvatazione delle molecole gassose dipende da alcune variabili quali: la temperatura del liquido, la pressione che lo influenza e la natura chimica di queste molecole rispetto a quelle del liquido..
Se la pressione esterna è troppo alta, aumentano le possibilità che il gas penetri nella superficie del liquido. E d'altra parte, le molecole gassose disciolte hanno più difficoltà a superare la pressione incidente per sfuggire all'esterno..
Se l'impianto gas liquido è in agitazione (come avviene in mare e nelle pompe d'aria all'interno dell'acquario), l'assorbimento del gas è favorito.
E in che modo la natura del solvente influisce sull'assorbimento di un gas? Se è polare, come l'acqua, mostrerà affinità per i soluti polari, cioè per quei gas che hanno un momento di dipolo permanente. Mentre se è apolare, come gli idrocarburi o i grassi, preferirà molecole gassose apolari
Ad esempio, l'ammoniaca (NH3) è un gas molto solubile in acqua a causa delle interazioni dei legami idrogeno. Mentre l'idrogeno (H.Due), la cui piccola molecola è apolare, interagisce debolmente con l'acqua.
Inoltre, a seconda dello stato del processo di assorbimento del gas nel liquido, possono essere stabiliti i seguenti stati:
Insaturi
Il liquido è insaturo quando è in grado di sciogliere più gas. Questo perché la pressione esterna è maggiore della pressione interna del liquido..
Saturato
Il liquido stabilisce un equilibrio nella solubilità del gas, il che significa che il gas fuoriesce alla stessa velocità con cui penetra nel liquido..
Può anche essere visto nel modo seguente: se tre molecole gassose fuoriescono nell'aria, altre tre torneranno nel liquido contemporaneamente.
Sovrasaturato
Il liquido è sovrasaturo di gas quando la sua pressione interna è maggiore della pressione esterna. E, con una variazione minima nel sistema, rilascerà il gas disciolto in eccesso fino al ripristino dell'equilibrio.
Applicazioni
- La legge di Henry può essere applicata per effettuare i calcoli di assorbimento di gas inerti (azoto, elio, argon, ecc.) Nei diversi tessuti del corpo umano, e che insieme alla teoria di Haldane sono alla base delle tabelle di decompressione.
- Un'applicazione importante è la saturazione dei gas nel sangue. Quando il sangue è insaturo, il gas si dissolve in esso, fino a quando non diventa saturo e smette di dissolversi ulteriormente. Una volta che ciò accade, il gas disciolto nel sangue passa nell'aria..
- La gassificazione delle bevande analcoliche è un esempio della legge di Henry applicata. Le bevande analcoliche hanno CODue disciolto ad alta pressione, mantenendo così ciascuno dei componenti combinati che lo compongono; inoltre conserva il caratteristico sapore più a lungo.
Quando la bottiglia di soda è aperta, la pressione sopra il liquido diminuisce, rilasciando la pressione istantaneamente.
Poiché la pressione sul liquido è ora inferiore, la solubilità della CODue discende e fuoriesce nell'ambiente (visibile nella risalita delle bolle dal fondo).

- Quando un subacqueo scende a profondità maggiori, l'azoto inalato non può fuoriuscire perché la pressione esterna lo impedisce, dissolvendosi nel sangue dell'individuo.
Quando il subacqueo risale rapidamente in superficie, dove la pressione esterna scende di nuovo, l'azoto inizia a bollire nel sangue..
Ciò causa la cosiddetta malattia da decompressione. È per questo motivo che i subacquei devono risalire lentamente, in modo che l'azoto fuoriesca più lentamente dal sangue..
- Studio degli effetti della diminuzione dell'ossigeno molecolare (ODue) disciolti nel sangue e nei tessuti di alpinisti o praticanti di attività che comportano una permanenza prolungata in alta quota, nonché negli abitanti di luoghi abbastanza elevati.
- Ricerca e miglioramento dei metodi utilizzati per evitare disastri naturali che possono essere causati dalla presenza di gas disciolti in enormi specchi d'acqua che possono essere rilasciati violentemente.
Esempi
La legge di Henry si applica solo quando le molecole sono in equilibrio. Ecco alcuni esempi:
- In ossigeno disciolto (ODue) nel fluido sanguigno, questa molecola è considerata scarsamente solubile in acqua, sebbene la sua solubilità sia notevolmente aumentata dall'elevato contenuto di emoglobina in essa contenuta. Pertanto, ogni molecola di emoglobina può legarsi a quattro molecole di ossigeno che vengono rilasciate nei tessuti per essere utilizzate nel metabolismo.
- Nel 1986 è stata registrata una spessa nube di anidride carbonica che è stata improvvisamente espulsa dal Lago Nyos (situato in Camerun), soffocando circa 1700 persone e un gran numero di animali, come spiegato da questa legge.
- La solubilità che un dato gas manifesta in una specie liquida tende ad aumentare all'aumentare della pressione di detto gas, sebbene ad alte pressioni ci siano alcune eccezioni, come le molecole di azoto (NDue).
- La legge di Henry non è applicabile quando c'è una reazione chimica tra la sostanza che funge da soluto e quella che funge da solvente; questo è il caso degli elettroliti, come l'acido cloridrico (HCl).
Riferimenti
- Crockford, H.D., Knight Samuel B. (1974). Fondamenti di fisicochimica. (6a ed.). Editoriale C.E.C.S.A., Messico. P 111-119.
- Gli editori dell'Encyclopaedia Britannica. (2018). Legge di Henry. Estratto il 10 maggio 2018 da: britannica.com
- Byju's. (2018). Qual è la legge di Henry? Estratto il 10 maggio 2018 da: byjus.com
- Leisurepro e Aquaviews. (2018). Legge di Henry Estratto il 10 maggio 2018 da: leisurepro.com
- Fondazione Annenberg. (2017). Sezione 7: Legge di Henry. Estratto il 10 maggio 2018 da: learner.org
- Monica Gonzalez. (25 aprile 2011). Legge di Henry. Estratto il 10 maggio 2018 da: quimica.laguia2000.com
- Ian Myles. (24 luglio 2009). Diver. [Figura]. Estratto il 10 maggio 2018 da: flickr.com



Nessun utente ha ancora commentato questo articolo.