
Legge delle applicazioni di azione di massa, esempi
Il legge dell'azione di massa stabilisce la relazione tra le masse attive dei reagenti e quella dei prodotti, in condizioni di equilibrio e in sistemi omogenei (soluzioni o fasi gassose). È stato formulato dagli scienziati norvegesi C.M. Guldberg e P. Waage, che hanno riconosciuto che l'equilibrio è dinamico e non statico.
Perché dinamico? Perché le velocità delle reazioni dirette e inverse sono uguali. Le masse attive sono generalmente espresse mol / L (molarità). Una tale reazione può essere scritta in questo modo: aA + bB <=> cC + dD. Per l'equilibrio menzionato in questo esempio, la relazione tra reagenti e prodotti è illustrata nell'equazione nell'immagine sotto.
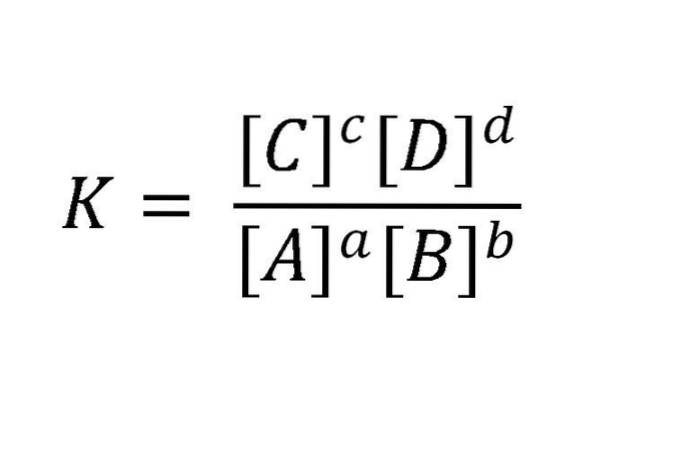
K è sempre costante, indipendentemente dalle concentrazioni iniziali delle sostanze, purché la temperatura non vari. Qui A, B, C e D sono i reagenti e i prodotti; mentre a, b, ced sono i loro coefficienti stechiometrici.
Il valore numerico di K è una costante caratteristica per ciascuna reazione a una data temperatura. Quindi, K è quella che viene chiamata costante di equilibrio.
La notazione [] significa che nell'espressione matematica le concentrazioni appaiono in unità di mol / L, elevate ad una potenza pari al coefficiente di reazione.
Indice articolo
- 1 Qual è la legge dell'azione di massa?
- 1.1 Significato della costante di equilibrio
- 2 Equilibrio chimico
- 2.1 Equilibrio in sistemi eterogenei
- 2.2 Spostamenti di equilibrio
- 3 Principio di Le Chatelier
- 4 Applicazioni
- 5 Esempi della legge dell'azione di massa
- 6 La legge dell'azione di massa in farmacologia
- 7 Limitazioni
- 8 Riferimenti
Qual è la legge dell'azione di massa?
Come accennato in precedenza, la legge dell'azione di massa esprime che la velocità di una data reazione è direttamente proporzionale al prodotto delle concentrazioni delle specie reagenti, dove la concentrazione di ciascuna specie è elevata ad una potenza pari al suo coefficiente stechiometrico nella sostanza chimica equazione.
In questo senso, può essere meglio spiegato avendo una reazione reversibile, la cui equazione generale è illustrata di seguito:
aA + bB ↔ cC + dD
Dove A e B rappresentano i reagenti e le sostanze denominate C e D rappresentano i prodotti della reazione. Allo stesso modo, i valori di a, b, ced rappresentano i coefficienti stechiometrici di A, B, C e D, rispettivamente..
Partendo dall'equazione precedente si ottiene la costante di equilibrio citata in precedenza, che viene illustrata come:
K = [C]c[D]d/[PER]per[B]b
Dove la costante di equilibrio K è uguale a un quoziente, in cui il numeratore è costituito dalla moltiplicazione delle concentrazioni dei prodotti (in stato di equilibrio) elevata al loro coefficiente nell'equazione bilanciata e il denominatore è costituito da una moltiplicazione simile ma tra i reagenti elevati al coefficiente che li accompagna.
Significato della costante di equilibrio
Si noti che nell'equazione per il calcolo della costante di equilibrio devono essere utilizzate le concentrazioni delle specie in equilibrio, purché non ci siano modifiche a queste o alla temperatura del sistema..
Allo stesso modo, il valore della costante di equilibrio fornisce informazioni sulla direzione che è favorita in una reazione all'equilibrio, cioè rivela se la reazione è favorevole nei confronti dei reagenti o dei prodotti..
Se la grandezza di questa costante è molto maggiore dell'unità (K "1), l'equilibrio si sposterà a destra e favorirà i prodotti; mentre se la grandezza di questa costante è molto minore dell'unità (K" 1), l'equilibrio essere inclinato a sinistra e favorirà i reagenti.
Inoltre, sebbene per convenzione sia indicato che le sostanze a sinistra della freccia sono i reagenti e quelle a destra sono i prodotti, il fatto che i reagenti che provengono dalla reazione in senso diretto diventano i prodotti nella reazione al contrario e viceversa.
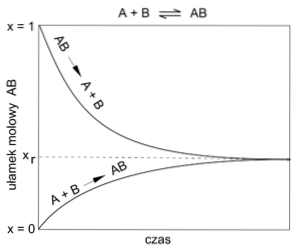
Equilibrio chimico
Le reazioni spesso raggiungono un equilibrio tra le quantità di sostanze di partenza e quelle dei prodotti che si formano. Questo equilibrio può inoltre spostarsi favorendo l'aumento o la diminuzione di una delle sostanze che partecipano alla reazione..
Un fatto analogo avviene nella dissociazione di una sostanza disciolta: durante una reazione si può osservare sperimentalmente con velocità variabile la scomparsa delle sostanze iniziali e la formazione dei prodotti.
La velocità di una reazione dipende fortemente dalla temperatura e in misura variabile dalla concentrazione dei reagenti. Questi fattori, infatti, vengono studiati soprattutto dalla cinetica chimica.
Tuttavia, questo equilibrio non è statico, ma deriva dalla coesistenza di una reazione diretta e inversa..
Nella reazione diretta (->) si formano i prodotti, mentre nella reazione inversa (<-) estos vuelven a originar las sustancias iniciales.
Quanto sopra costituisce ciò che è noto come equilibrio dinamico, di cui sopra..
Equilibrio in sistemi eterogenei
In sistemi eterogenei, cioè in quelli formati da più fasi, le concentrazioni dei solidi possono essere considerate costanti, omettendo dall'espressione matematica per K.
Ladro3(S) <=> CaO (s) + CODue(g)
Pertanto, nell'equilibrio di decomposizione del carbonato di calcio, la sua concentrazione e quella dell'ossido risultante possono essere considerate costanti indipendentemente dalla sua massa..
Cambiamenti di equilibrio
Il valore numerico della costante di equilibrio determina se una reazione favorisce o meno la formazione dei prodotti. Quando K è maggiore di 1, il sistema di equilibrio avrà una concentrazione di prodotti maggiore rispetto a quella di reagenti, e se K è minore di 1, avviene il contrario: in equilibrio ci sarà una concentrazione di reagenti maggiore rispetto ai prodotti..
Principio di Le Chatelier
L'influenza delle variazioni di concentrazione, temperatura e pressione può alterare la velocità di una reazione.
Ad esempio, se in una reazione si formano prodotti gassosi, un aumento della pressione sul sistema fa sì che la reazione si svolga nella direzione opposta (verso i reagenti).
In generale, le reazioni inorganiche che avvengono tra gli ioni sono molto veloci, mentre quelle organiche hanno velocità molto inferiori..
Se si produce calore in una reazione, un aumento della temperatura esterna tende ad orientarlo nella direzione opposta, poiché la reazione inversa è endotermica (assorbe calore).
Allo stesso modo, se si verifica un eccesso in una delle sostanze reagenti all'interno di un sistema in equilibrio, le altre sostanze formeranno prodotti per neutralizzare quanto più possibile detta modificazione..
Di conseguenza, l'equilibrio si sposta favorendo in una direzione o nell'altra aumentando la velocità di reazione, in modo tale che il valore di K rimanga costante..
Tutte queste influenze esterne e la risposta dell'equilibrio per contrastarle è ciò che è noto come il principio di Le Chatelier..
Applicazioni
Nonostante la sua enorme utilità, quando è stata proposta questa legge non ha avuto l'impatto o la rilevanza desiderati nella comunità scientifica.
Tuttavia, dal ventesimo secolo stava guadagnando notorietà grazie al fatto che gli scienziati britannici William Esson e Vernon Harcourt lo ripresero diversi decenni dopo la sua promulgazione..
La legge dell'azione di massa ha avuto molte applicazioni nel tempo, alcune delle quali sono elencate di seguito:
- Poiché è formulato in termini di attività piuttosto che di concentrazioni, è utile per determinare deviazioni dal comportamento ideale dei reagenti in una soluzione, purché coerente con la termodinamica..
- Quando una reazione si avvicina all'equilibrio, è possibile prevedere la relazione tra la velocità netta della reazione e l'energia libera di Gibbs istantanea di una reazione..
- Quando combinata con il principio di equilibrio dettagliato, in termini generali questa legge fornisce i valori risultanti, in base alla termodinamica, delle attività e della costante nello stato di equilibrio, nonché la relazione tra queste e le costanti di velocità risultanti delle reazioni in avanti e invertire le direzioni.
- Quando le reazioni sono di tipo elementare, applicando questa legge si ottiene l'equazione di equilibrio appropriata per una certa reazione chimica e le espressioni della sua velocità.
Esempi della legge dell'azione di massa
-Quando si studia una reazione irreversibile tra ioni trovati in soluzione, l'espressione generale di questa legge porta alla formulazione di Brönsted-Bjerrum, che stabilisce la relazione tra la forza ionica della specie e la costante di velocità.
-Analizzando le reazioni che si svolgono in soluzioni ideali diluite o in uno stato di aggregazione gassosa, si ottiene l'espressione generale della legge originaria (decennio degli anni '80).
-Poiché ha caratteristiche universali, l'espressione generale di questa legge può essere utilizzata come parte della cinetica invece di vederla come parte della termodinamica.
-Quando viene utilizzata in elettronica, questa legge viene utilizzata per determinare che la moltiplicazione tra le densità dei fori e gli elettroni di una data superficie ha una grandezza costante nello stato di equilibrio, anche indipendentemente dal drogaggio che viene fornito al materiale..
-L'uso di questa legge per descrivere le dinamiche tra predatori e prede è ampiamente noto, assumendo che il rapporto di predazione sulla preda presenti una certa proporzione con il rapporto tra predatori e prede..
-Nel campo degli studi sulla salute, questa legge può essere applicata anche per descrivere alcuni fattori del comportamento umano, dal punto di vista politico e sociale.
La legge dell'azione di massa in farmacologia
Assumendo che D sia il farmaco e R il recettore su cui agisce, entrambi reagiscono dando origine al complesso DR, responsabile dell'effetto farmacologico:
K = [DR] / [D] [R]
K è la costante di dissociazione. C'è una reazione diretta in cui il farmaco agisce sul recettore e un'altra in cui il complesso DR si dissocia nei composti originali. Ogni reazione ha una sua velocità, eguagliandosi solo all'equilibrio, soddisfacendo K.
Interpretando la legge di massa alla lettera, maggiore è la concentrazione di D, maggiore è la concentrazione del complesso DR formato..
Tuttavia, i ricevitori Rt totali hanno un limite fisico, quindi non esiste una quantità illimitata di R per tutti i D. Allo stesso modo, studi sperimentali nel campo della farmacologia hanno trovato i seguenti limiti alla legge di massa in questo campo:
- Presume che il legame R-D sia reversibile, quando nella maggior parte dei casi non lo è davvero..
- Il legame R-D può alterare strutturalmente uno qualsiasi dei due componenti (il farmaco o il recettore), una circostanza che non tiene conto della legge di massa.
- Inoltre, la legge di massa impallidisce di fronte alle reazioni in cui più intermediari intervengono nella formazione di RD..
Limitazioni
La legge dell'azione di massa presuppone che ogni reazione chimica sia di tipo elementare; in altre parole, che la molecolarità è la stessa del rispettivo ordine di reazione per ciascuna specie coinvolta.
Qui i coefficienti stechiometrici a, b, ce d sono considerati come il numero di molecole coinvolte nel meccanismo di reazione. Tuttavia, in una reazione globale, questi non coincidono necessariamente con il loro ordine..
Ad esempio, per la reazione aA + bB <=> cC + dD:
Le espressioni di velocità per le reazioni dirette e inverse sono:
K1= [A]per[B]b
KDue= [C]c[D]d
Questo vale solo per le reazioni elementari, poiché per quelle globali, sebbene i coefficienti stechiometrici siano corretti, non sono sempre gli ordini di reazione. Nel caso della reazione diretta, quest'ultima potrebbe essere:
K1= [A]w[B]z
In questa espressione w e z sarebbero i veri ordini di reazione per le specie A e B.
Riferimenti
- Jeffrey Aronson. (2015, 19 novembre). Le leggi della vita: legge di azione di massa di Guldberg e Waage. Estratto il 10 maggio 2018 da: cebm.net
- ScienceHQ. (2018). Legge dell'azione di massa. Estratto il 10 maggio 2018 da: sciencehq.com
- askiitani. (2018). Legge di azione di massa e costante di equilibrio. Estratto il 10 maggio 2018 da: askiitians.com
- Salvat Encyclopedia of Sciences. (1968). Chimica. Volume 9, Salvat S.A. di edizioni Pamplona, Spagna. P 13-16.
- Walter J. Moore. (1963). Chimica fisica. Nel Termodinamica ed equilibrio chimico. (Quarto ed.). Longmans. P 169.
- Alex Yartsev. (2018). La legge dell'azione di massa in farmacodinamica. Estratto il 10 maggio 2018 da: derangedphysiology.com



Nessun utente ha ancora commentato questo articolo.