
Caratteristiche isobariche, esempi e differenze con gli isotopi

Il isobare Sono quelle specie atomiche che hanno la stessa massa ma che provengono da elementi chimici diversi. Di conseguenza, si può dire che sono costituiti da un numero diverso di protoni e neutroni.
Sia i protoni che i neutroni si trovano nel nucleo dei loro atomi, ma il numero netto di neutroni e protoni presenti in ciascun nucleo rimane lo stesso. In altre parole, una specie isobara ha origine quando una coppia di nuclei atomici mostra lo stesso numero netto di neutroni e protoni per ciascuna specie..
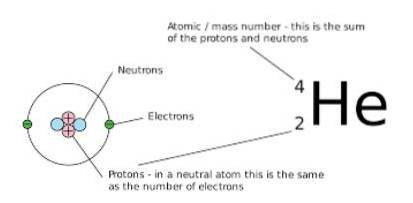
Tuttavia, il numero di neutroni e protoni che compongono tale quantità netta è diverso. Un modo per notarlo graficamente è osservare il numero di massa (che è posto in alto a sinistra del simbolo dell'elemento chimico che è rappresentato), perché nelle isobare questo numero è lo stesso.
Indice articolo
- 1 Caratteristiche
- 1.1 Rappresentanza
- 2 esempi
- 3 Differenze tra isobare e isotopi
- 4 Riferimenti
Caratteristiche
In primo luogo, l'etimologia del termine isobaro deriva dalle parole greche isos (che significa "uguale") e baros (che significa "peso"), che si riferisce all'uguaglianza di pesi tra le due specie nucleari.
Va notato che le isobare hanno alcune somiglianze con altre specie i cui nuclei hanno coincidenze, come gli isotoni, che hanno lo stesso numero di neutroni ma con numeri di massa e numeri atomici diversi, come le coppie 13C e 14Non 36S e 37Cl.
D'altra parte, il termine "nuclide" è il nome che è stato coniato a ciascuno degli insiemi di nucleoni (strutture costituite da neutroni e protoni) che possono essere formati.
Così che i nuclidi si distinguono forse per il loro numero di neutroni o protoni, o anche per la quantità di energia posseduta dalla struttura del loro conglomerato..
Allo stesso modo, un nucleo figlia nasce dopo il processo di decadimento β e questo, a sua volta, è un'isobara del nucleo genitore, perché il numero di nucleoni presenti nel nucleo rimane invariato, a differenza di quanto avviene per mezzo del decadimento α.
È importante ricordare che diverse isobare hanno numeri atomici diversi, a conferma che sono elementi chimici diversi..
Rappresentazione
Per denotare i diversi nuclidi, viene utilizzata una notazione specifica, che può essere rappresentata in due modi: uno consiste nel porre il nome dell'elemento chimico seguito dal suo numero di massa, che sono collegati da un trattino. Ad esempio: azoto-14, il cui nucleo è composto da sette neutroni e sette protoni.
L'altro modo di rappresentare queste specie è posizionare il simbolo dell'elemento chimico, preceduto da un apice numerico che indica il numero di massa dell'atomo in questione, nonché da un pedice numerico che designa il suo numero atomico, nel modo seguente:
ZPERX
In questa espressione X rappresenta l'elemento chimico dell'atomo in questione, A è il numero di massa (risultato della somma tra il numero di neutroni e protoni) e Z rappresenta il numero atomico (uguale al numero di protoni nel nucleo del atomo).
Quando questi nuclidi sono rappresentati, il numero atomico dell'atomo (Z) viene solitamente omesso perché non fornisce dati aggiuntivi rilevanti, quindi è spesso rappresentato come PERX.
Un modo per mostrare questa notazione è prendere l'esempio precedente (azoto-14), che è anche indicato come 14N. Questa è la notazione usata per le isobare.
Esempi
L'uso dell'espressione "isobare" per specie note come nuclidi che hanno lo stesso numero di nucleoni (uguale numero di massa) fu proposto alla fine degli anni '10 dal chimico britannico Alfred Walter Stewart..
In questo ordine di idee, si può osservare un esempio di isobare nel caso della specie 14C e 14N: il numero di massa è uguale a 14, questo implica che il numero di protoni e neutroni in entrambe le specie è diverso.
In effetti, questo atomo di carbonio ha un numero atomico pari a 6, quindi ci sono 6 protoni nella sua struttura, ea sua volta ha 8 neutroni nel suo nucleo. Quindi il suo numero di massa è 14 (6 + 8 = 14).
Da parte sua, l'atomo di azoto ha un numero atomico pari a 7, quindi è composto da 7 protoni, ma ha anche 7 neutroni nel suo nucleo. Anche il suo numero di massa è 14 (7 + 7 = 14).
Puoi anche trovare una serie in cui tutti gli atomi hanno un numero di massa pari a 40; questo è il caso delle isobare: 40AC, 40K, 40Ar, 40Cl e 40S.
Differenze tra isobare e isotopi
Come spiegato in precedenza, i nuclidi descrivono le diverse classi di nuclei atomici esistenti, in base al numero di protoni e neutroni che hanno..
Inoltre, tra questi tipi di nuclidi ci sono isobari e isotopi, che saranno differenziati di seguito.
Nel caso delle isobare, come accennato prima, hanno lo stesso numero di nucleoni, cioè lo stesso numero di massa, dove il numero di protoni per cui una specie è maggiore dell'altra concorda con il numero di neutroni. sono in deficit, quindi il totale è lo stesso. Tuttavia, il suo numero atomico è diverso.
In questo senso, le specie isobare provengono da diversi elementi chimici, quindi si trovano in diversi spazi della tavola periodica e hanno caratteristiche e proprietà specifiche diverse..
Nel caso invece degli isotopi accade il contrario, poiché hanno lo stesso numero atomico ma differenti quantità di massa; cioè, hanno lo stesso numero di protoni ma un numero diverso di neutroni all'interno dei loro nuclei atomici..
Inoltre, gli isotopi sono specie atomiche appartenenti agli stessi elementi, quindi si trovano nello stesso spazio della tavola periodica e hanno caratteristiche e proprietà simili..
Riferimenti
- Wikipedia. (s.f.). Isobar (nuclide). Estratto da en.wikipedia.org
- Britannica, E. (s.f.). Isobara. Estratto da britannica.com
- Konya, J. e Nagy, N. M. (2018). Nucleare e radiochimica. Recupero da books.google.co.ve
- Educazione energetica. (s.f.). Isobar (nucleare). Estratto da energyeducation.ca
- Vista tutor. (s.f.). Nuclei. Recupero da physics.tutorvista.com



Nessun utente ha ancora commentato questo articolo.