
Struttura, proprietà, usi dell'idrossido di ferro (II)
Il idrossido di ferro (II), detto anche idrossido ferroso, è un composto inorganico con formula chimica Fe (OH)Due. Se la tua purezza è alta, il tuo solido è costituito solo da ioni FeDue+ e OH- in un rapporto 2: 1; tuttavia può contenere molecole d'acqua e diverse specie ioniche, modificandone la posizione.
Rappresenta la forma “ridotta” della famosa ruggine, una superficie rossastra composta da ioni Fe.3+; mentre nella ruggine verdastra predomina FeDue+, accanto all'OH- e altre quantità di anioni: CO3Due-, SW4Due-, NON3- e alogenuri (F-, Cl-,… ), per esempio. Il risultato, sebbene la base di questa ruggine verde sia Fe (OH)Due, è che si ottengono vari solidi.

Nella vita quotidiana questo idrossido può essere visto nei luoghi comuni. Ad esempio, la barca nella foto sopra ha la sua superficie ricoperta di ruggine verde (non patina). C'è la fede (OH)Due, ma accompagnato da numerosi ioni dalle onde del mare.
Chimicamente parlando, le proprietà e gli usi di questo materiale dipendono dal catione Fe.Due+ e la sua tendenza a ossidarsi per diventare il Fe3+. È un agente riducente, che reagisce rapidamente con l'ossigeno in condizioni basiche. Pertanto deve essere utilizzato in atmosfere inerti e in soluzioni acide..
Indice articolo
- 1 Struttura dell'idrossido di ferro (II)
- 1.1 Collegamenti
- 1.2 Doppi strati di idrossido
- 1.3 Idrata
- 1.4 Ruggine verde e rossa
- 2 Proprietà
- 3 usi
- 3.1 Analisi organica qualitativa
- 3.2 Riduttore di selenio oxoanion
- 3.3 Materiali a doppio strato
- 4 Riferimenti
Struttura dell'idrossido di ferro (II)
Collegamenti
Considerando solo Fe (OH)Due puro, non ha altro che ioni FeDue+ e OH-.
Le interazioni tra loro devono, in teoria, essere di natura ionica; ogni catione FeDue+ attrae due anioni OH-, le cui attrazioni non direzionali finiscono per stabilire un ordine strutturale e ripetitivo che definisce un cristallo; che a sua volta dà origine a polvere di ruggine verde.
Il problema è che esiste un certo carattere covalente tra entrambi gli ioni e quindi un legame ionico Fe-OH non può essere ignorato. Considerando un legame Fe-OH parzialmente ionico, si può capire che sono raggruppati in una sorta di strato polimerico.
Doppi strati di idrossido
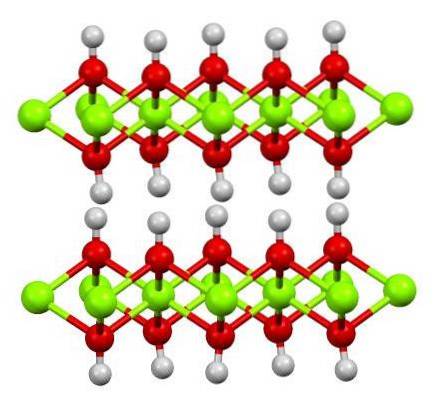
La struttura dell'idrossido ferroso puro è mostrata sopra con un modello a sfera e bastone. I cationi FeDue+ sono rappresentate dalle sfere verde brillante, mentre gli anioni OH- dalle sfere rosse e bianche. Nota come si allineano gli ioni FeDue+ grazie alle interazioni (ionico-covalenti) con l'OH-.
Perché questa struttura è chiamata doppi strati di idrossido? L'immagine stessa offre la risposta: ci sono due righe o strati di OH- per ciascuno di fedeDue+; cioè, viene mantenuto il rapporto 2: 1 di Fe (OH)Due menzionato all'inizio.
Unità strutturali per Fe (OH)Due sono quindi questi panini, dove gli strati di OH- verrebbero a rappresentare i pani; pani caricati negativamente che quindi non riescono a impostare correttamente per definire un sorprendente cristallo marrone.
Ma d'altra parte, anche gli atomi di H si allineano e si oscurano a vicenda. Ricordando il concetto di polarità ed elettronegatività, questi idrogeni hanno una leggera carica parziale positiva, δ +; che, sebbene debole, può avere una zona positiva dove sono alloggiati altri anioni o molecole.
Idrata
Quando il Fe (OH)Due si dissolve in acqua, le sue molecole si coordinano con il centro metallico di FeDue+ per formare un complesso acquoso: [Fe (HDueO)4(OH)Due]. Questo complesso ha una geometria ottaedrica perché ha sei ligandi: quattro molecole d'acqua e due molecole OH.-. Tuttavia, nell'idrossido ferroso idrato il quadro è leggermente diverso..
Nell'idrato, dell'ipotetica formula Fe (OH)DueNHDueOppure, le molecole d'acqua sono alloggiate esattamente tra i due strati di idrossido; cioè, interagiscono attraverso forze di ioni dipolo con idrogeni o sfere bianche. È come se si afferrassero due panini OHFeOH e si inserisse dell'acqua per raggrupparli: OHFeOH (HDueO) OHFeOH.
Le molecole d'acqua sono molto dinamiche, impediscono alle particelle di idrato di acquisire dimensioni considerevoli e, di conseguenza, formano un solido colloidale o gelatinoso..
Ruggine verde e rossa
Negli idrati gli strati di idrossido hanno molecole d'acqua intervallate; tuttavia, possono avere altri anioni (già menzionati), che causano un'ampia varietà di ruggine verdi. Allo stesso modo, possono persino "intrappolare" molecole grandi come DNA o farmaci.
Non solo possono essere presenti ioni FeDue+, ma anche Fede3+, prodotto dell'ossidazione interna causata dall'ossigeno intercalato. Si osserverà visibilmente che la ruggine (o ossido) verde inizia a diventare rossastra all'aumentare della concentrazione di Fe.3+.
Proprietà

Fe (OH) mostrato sopraDue precipitato in una provetta. Essendo in abbondante acqua, la struttura acquosa complessa dovrebbe predominare sulla struttura appena accennata. Si osservi che la superficie presenta un colore arancio, prodotto dell'ossidazione del FeDue+ alla fede3+ dall'ossigeno nell'aria; cioè, questo idrossido è un agente riducente:
FedeDue+ <=> Fede3+ + e-
L'aspetto fisico di questo composto allo stato puro è quello di un solido marrone:

Che, a seconda del suo livello di umidità, può apparire come un solido verde gelatinoso. È abbastanza insolubile in acqua (Ksp= 8 10-16 e solubilità = 0,72 g / 100 ml a 25 ° C) e ha una massa molare di 89,86 g / mol e una densità di 3,4 g / ml.
Non sono riportati punti di ebollizione o di fusione per questo composto; probabilmente per il fatto che, prima di una fonte di calore, si disidrata e si converte in ossido ferroso, FeO:
Fe (OH)Due => FeO + HDueO
Applicazioni
Analisi organica qualitativa
Il suo potere riducente viene utilizzato per determinare la presenza di nitrocomposti, RNODue. La reazione per cui si ottiene un test positivo è rappresentata dalla seguente equazione chimica:
RNODue + 6Fe (OH)Due + 4HDueO => RNHDue + 6Fe (OH)3
Il Fe (OH)3 precipita come un solido bruno-rossastro, che certifica la presenza del gruppo nitro, -NODue.
Riduttore di selenio oxoanion
Il potere riducente del Fe (OH)Due è stato anche utilizzato per ridurre gli anioni SeO3Due- (selenite) e SeO4Due- (selenato) al selenio elementare, Se. In pratica, consente la rimozione di tali anioni, dannosi per la salute, sotto forma di un solido di selenio insolubile e facilmente estraibile.
Materiali a doppio strato
La sua struttura pura, e il verde ruggine, è fonte di ispirazione per la progettazione di nuovi materiali con caratteristiche mineralogiche..
Si stima che la loro funzione sia quella di consentire il trasporto di una specifica specie tra i suoi strati, in modo tale che il suo rilascio nel sito attivo (suoli, cellule, superficie metallica, ecc.) Possa essere controllato o ridotto..
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Idrossido di ferro (II). Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Idrossido ferroso. Database PubChem. CID = 10129897. Estratto da: pubchem.ncbi.nlm.nih.gov
- Nick Doe. (s.f.). Test per fenoli e gruppi nitro. Chimica 211. Estratto da: academics.wellesley.edu
- Clark Jim. (27 aprile 2019). Chimica del ferro. Chemistry LibreTexts. Recupero da: chem.libretexts.org
- Software tecnico Kingston. (2019). Chimica della ruggine. Medici della corrosione. Estratto da: corrosione-doctors.org
- Zingaro, Ralph A. et al. (1997). Riduzione degli anioni di ossoselenio da parte dell'idrossido di ferro (II). Ambiente internazionale. 23 (3): 299-304. doi: 10.1016 / S0160-4120 (97) 00032-9



Nessun utente ha ancora commentato questo articolo.