
Struttura, proprietà, usi, rischi dell'idrossido di alluminio
Il idrossido di alluminio è un composto inorganico la cui formula chimica è Al (OH)3. A differenza di altri idrossidi metallici, è anfotero, in grado di reagire o comportarsi come un acido o una base, a seconda del mezzo. È un solido bianco abbastanza insolubile in acqua, quindi trova impiego come componente di antiacidi.
Come Mg (OH)Due oppure la brucite, con la quale condivide determinate caratteristiche chimico-fisiche, allo stato puro si presenta come un solido opaco, amorfo; ma quando cristallizza con alcune impurità acquista forme cristalline come se fossero perle. Tra questi minerali, fonti naturali di Al (OH)3, il gibbsite viene trovato.

Oltre al gibbsite sono presenti anche i minerali bayerite, nordstrandite e doleyite, che costituiscono i quattro polimorfi dell'idrossido di alluminio. Strutturalmente sono molto simili tra loro, difficilmente differiscono nel modo in cui gli strati o fogli di ioni sono posizionati o accoppiati, nonché il tipo di impurità contenute.
Controllando il pH e i parametri di sintesi, uno qualsiasi di questi polimorfi può essere preparato. Inoltre, alcune specie chimiche di interesse possono essere intercalate tra i suoi strati, in modo da creare materiali o composti di intercalazione. Questo rappresenta l'uso di un approccio più tecnologico per Al (OH)3. I suoi altri usi sono come antiacidi.
D'altra parte, viene utilizzato come materia prima per ottenere allumina e le sue nanoparticelle sono state utilizzate come supporto catalitico..
Indice articolo
- 1 Struttura
- 1.1 Formula e ottaedro
- 1.2 polimorfi
- 2 Proprietà
- 2.1 Aspetto fisico
- 2.2 Massa molare
- 2.3 Densità
- 2.4 Punto di fusione
- 2.5 Solubilità in acqua
- 2.6 Prodotto di solubilità
- 2.7 Anfoterismo
- 3 Nomenclatura
- 4 Usi
- 4.1 Materia prima
- 4.2 Supporti catalitici
- 4.3 Composti di intercalazione
- 4.4 Ignifugo
- 4.5 Medicinale
- 4.6 Adsorbente
- 5 Rischi
- 6 Riferimenti
Struttura
Formula e ottaedro
La formula chimica Al (OH)3 indica subito che la relazione Al3+: OH- è 1: 3; cioè, ci sono tre anioni OH- per ogni catione Al3+, il che equivale a dire che un terzo dei suoi ioni corrisponde all'alluminio. Pertanto, l'Al3+ e OH- interagiscono elettrostaticamente fino a quando le loro attrazione-repulsioni definiscono un cristallo esagonale.
Tuttavia, l'Al3+ non necessariamente circondato da tre OH- ma sei; quindi, si parla di un ottaedro di coordinazione, Al (OH)6, in cui ci sono sei interazioni Al-O. Ogni ottaedro rappresenta un'unità con cui è costruito il cristallo, e alcuni di essi adottano strutture tricliniche o monocliniche.
L'immagine in basso rappresenta parzialmente l'ottaedro Al (OH)6, poiché si osservano solo quattro interazioni per l'AI3+ (sfere marrone chiaro).
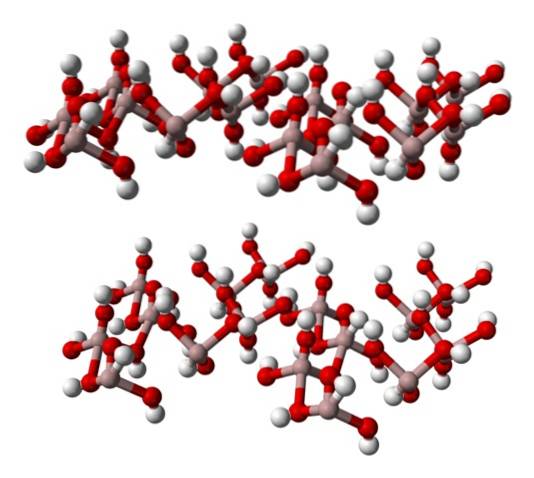
Se si osserva attentamente questa struttura, che corrisponde a quella del gibbsite minerale, si può vedere che le sfere bianche costituiscono le "facce" o superfici degli strati ionici; questi sono gli atomi di idrogeno degli ioni OH-.
Nota anche che c'è uno strato A e un altro B (spazialmente non sono identici), uniti tra loro da legami idrogeno..
Polimorfi
Gli strati A e B non sono sempre accoppiati allo stesso modo, proprio come possono cambiare i loro ambienti fisici o gli ioni ospiti (sali). Di conseguenza, cristalli di Al (OH)3 variano in quattro forme mineralogiche o, in questo caso, polimorfiche.
Si dice quindi che l'idrossido di alluminio abbia fino a quattro polimorfi: gibbsite o idrargillite (monoclino), bayerite (monoclino), doyleite (triclino) e nordstrandite (triclino). Di questi polimorfi, il gibbsite è il più stabile e abbondante; gli altri sono classificati come minerali rari.
Se i cristalli fossero osservati al microscopio, si vedrebbe che la loro geometria è esagonale (sebbene alquanto irregolare). Il pH gioca un ruolo importante nella crescita di tali cristalli e sulla struttura risultante; cioè, dato un pH, si può formare un polimorfo o un altro.
Ad esempio, se il mezzo in cui precipita Al (OH)3 ha un pH inferiore a 5,8 gibbsite si forma; mentre se il pH è superiore a questo valore si forma la bayerite.
In media più elementari, i cristalli di nordstrandite e doyleite tendono a formarsi. Quindi, essendo il gibbsite più abbondante, è un fatto che riflette l'acidità dei suoi ambienti alterati..
Proprietà
Aspetto fisico
Solido bianco che può essere di diversi formati: granulare o in polvere e di aspetto amorfo.
Massa molare
78,00 g / mol
Densità
2,42 g / mL
Punto di fusione
300 ° C. Non ha punto di ebollizione perché l'idrossido perde acqua per trasformarsi in allumina o ossido di alluminio, AlDueO3.
Solubilità dell'acqua
1 10-4 g / 100 mL. Tuttavia, la sua solubilità aumenta con l'aggiunta di acidi (H.3O+) o alcali (OH-).
Prodotto di solubilità
Ksp = 3 10−34
Questo valore molto piccolo significa che solo una piccola porzione si dissolve in acqua:
Al (OH)3(S) <=> Al3+(aq) + 3OH-(AC)
Ed infatti questa trascurabile solubilità lo rende un buon neutralizzatore di acidità, poiché non basifica troppo l'ambiente gastrico perché non rilascia quasi ioni OH.-.
Anfoterismo
El Al (OH)3 si caratterizza per il suo carattere anfotero; cioè può reagire o comportarsi come se fosse un acido o una base.
Ad esempio, reagisce con gli ioni H.3O+ (se il mezzo è acquoso) per formare il complesso acquoso [Al (OHDue)6]3+; che a sua volta viene idrolizzato per acidificare il mezzo, quindi Al3+ uno ione acido:
Al (OH)3(s) + 3H3O+(ac) => [Al (OHDue)6]3+(AC)
[Al (OHDue)6]3+(ac) + HDueO (l) <=> [Al (OHDue)5(OH)]Due+(ac) + H3O+(AC)
Quando ciò accade, si dice che l'Al (OH)3 si comporta come una base, poiché reagisce con l'H3O+. D'altra parte, può reagire con l'OH-, comportandosi come un acido:
Al (OH)3(s) + OH-(ac) => Al (OH)4-(AC)
In questa reazione il precipitato bianco di Al (OH)3 si dissolve in eccesso di ioni OH-; fatto che non accade lo stesso con altri idrossidi, come il magnesio, Mg (OH)Due.
El Al (OH)4-, ione alluminato, può essere più appropriatamente espresso come: [Al (OHDue)Due(OH)4]-, evidenziando il numero di coordinamento 6 per il catione Al3+ (l'ottaedro).
Questo ione può continuare a reagire con più OH- fino a completare l'ottaedro di coordinazione: [Al (OH)6]3-, chiamato ione esaidrossoalluminato.
Nomenclatura
La denominazione "idrossido di alluminio", con la quale si è fatto più riferimento a questo composto, corrisponde a quella disciplinata dalla nomenclatura stock. La (III) viene omessa alla fine, poiché lo stato di ossidazione dell'alluminio è +3 in tutti i suoi composti.
Gli altri due nomi possibili per riferirsi ad Al (OH)3 Sono: triidrossido di alluminio, secondo la nomenclatura sistematica e l'uso dei prefissi del numeratore greco; e idrossido di alluminio, che termina con il suffisso -ico per avere un unico stato di ossidazione.
Sebbene in campo chimico la nomenclatura di Al (OH)3 non rappresenta alcuna sfida o confusione, al di fuori tende a mescolarsi con ambiguità.
Ad esempio, il minerale gibbsite è uno dei polimorfi naturali di Al (OH)3, che chiamano anche γ-Al (OH)3 o α-Al (OH)3. Tuttavia, α-Al (OH)3 può anche corrispondere alla bayerite minerale, o β-Al (OH)3, secondo la nomenclatura cristallografica. Nel frattempo, i polimorfi nordstrandite e doyleite sono solitamente designati semplicemente come Al (OH)3.
Il seguente elenco riassume chiaramente quanto appena spiegato:
-Gibbsite: (γ o α) -Al (OH)3
-Bayerite: (α o β) -Al (OH)3
-Nordstrandite: Al (OH)3
-Doyleite: Al (OH)3
Applicazioni
Materiale grezzo
L'uso immediato dell'idrossido di alluminio è come materia prima per la produzione di allumina o altri composti, inorganici o organici, dell'alluminio; ad esempio: AlCl3, Da no3)3, AlF3 o NaAl (OH)4.
Supporti catalitici
Nanoparticelle di Al (OH)3 possono fungere da supporti catalitici; cioè il catalizzatore li unisce per rimanere fisso sulla loro superficie, dove le reazioni chimiche vengono accelerate.
Composti di intercalazione
Nella sezione sulle strutture è stato spiegato che Al (OH)3 È costituito da strati o fogli A e B, accoppiati per definire un cristallo. Al suo interno ci sono piccoli spazi o fori ottaedrici che possono essere occupati da altri ioni, molecole metalliche o organiche, o neutre..
Quando i cristalli di Al (OH) vengono sintetizzati3 Con queste modifiche strutturali, si dice che si sta preparando un composto di intercalazione; cioè, inseriscono o inseriscono specie chimiche tra i fogli A e B. In tal modo, emergono nuovi materiali realizzati da questo idrossido.
Ignifugo
El Al (OH)3 è un buon ritardante di fiamma che trova applicazione come materiale di riempimento per molte matrici polimeriche. Questo perché assorbe il calore per rilasciare vapore acqueo, proprio come fa Mg (OH).Due o la brucita.
Medicinale
El Al (OH)3 È anche un neutralizzatore dell'acidità, reagendo con l'HCl nelle secrezioni gastriche; di nuovo, in modo simile a Mg (OH)Due latte di magnesia.
Entrambi gli idrossidi possono infatti essere miscelati in diversi antiacidi, utilizzati per alleviare i sintomi di persone che soffrono di gastrite o ulcere gastriche..
Assorbente
Quando riscaldato al di sotto del suo punto di fusione, l'idrossido di alluminio si trasforma in allumina attivata (così come carbone attivo). Questo solido viene utilizzato come adsorbente per molecole indesiderabili, siano esse coloranti, impurità o gas inquinanti..
Rischi
I rischi che l'idrossido di alluminio può comportare non sono dovuti ad esso come solido, ma come medicinale. Non necessita di alcun protocollo o regolamento per conservarlo, poiché non reagisce vigorosamente con agenti ossidanti e non è infiammabile..
Se ingerito negli antiacidi disponibili nelle farmacie, possono verificarsi effetti collaterali indesiderati, come costipazione e inibizione del fosfato nell'intestino. Allo stesso modo, e sebbene non ci siano studi per dimostrarlo, è stato associato a disturbi neurologici come il morbo di Alzheimer.
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Idrossido di alluminio. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Idrossido di alluminio. Database PubChem. CID = 10176082. Estratto da: pubchem.ncbi.nlm.nih.gov
- Danielle Reid. (2019). Idrossido di alluminio: formula ed effetti collaterali. Studia. Estratto da: study.com
- Robert Schoen e Charles E. Roberson. (1970). Strutture di idrossido di alluminio e implicazioni geochimiche. The American Mineralogist, Vol 55.
- Vitaly P. Isupov e col. (2000). Sintesi, struttura, proprietà e applicazione dei composti di intercalazione dell'idrossido di alluminio. Chimica per lo sviluppo sostenibile 8,121-127.
- Droghe. (24 marzo 2019). Effetti collaterali di idrossido di alluminio. Estratto da: drug.com



Nessun utente ha ancora commentato questo articolo.