
Proprietà, nomenclatura, reazioni, tipi degli idrocarburi alifatici
Il Idrocarburi alifatici sono tutti quelli che mancano di aromaticità, non in senso olfattivo, ma per quanto riguarda la stabilità chimica. Classificare gli idrocarburi in questo modo è oggigiorno troppo ambiguo e impreciso, poiché non discrimina tra vari tipi di idrocarburi non aromatici..
Quindi, abbiamo idrocarburi alifatici e idrocarburi aromatici. Questi ultimi sono riconosciuti dalla loro unità di base: l'anello benzenico. Gli altri, invece, possono adottare qualsiasi struttura molecolare: lineare, ramificata, ciclica, insatura, policiclica; fintanto che non hanno sistemi coniugati come il benzene.

Il termine "alifatico" nasce dalla parola greca "aleiphar", che significa grasso, usata anche per riferirsi agli oli. Pertanto, nell'Ottocento questa classificazione fu assegnata agli idrocarburi ottenuti da estratti oleosi; mentre gli idrocarburi aromatici venivano estratti da resine arboree e profumate.
Tuttavia, man mano che si consolidavano le basi della chimica organica, si è scoperto che esisteva una proprietà chimica che differenziava gli idrocarburi, ancora più importante delle loro fonti naturali: l'aromaticità (e non la fragranza).
In questo modo gli idrocarburi alifatici cessavano di essere solo quelli ottenuti dai grassi, per essere tutti quelli privi di aromaticità. All'interno di questa famiglia abbiamo alcani, alcheni e alchini, indipendentemente dal fatto che siano lineari o ciclici. Ecco perché "alifatico" è considerato impreciso; sebbene sia utile affrontare alcuni aspetti generali.
Ad esempio, quando dici "estremità" o "catene" alifatiche, ti riferisci a regioni molecolari in cui gli anelli aromatici sono assenti. Di tutti gli idrocarburi alifatici, il più semplice per definizione è il metano, CH4; mentre il benzene è il più semplice degli idrocarburi aromatici.
Indice articolo
- 1 Proprietà degli idrocarburi alifatici
- 2 Nomenclatura
- 3 Reazioni
- 3.1 Combustione
- 3.2 Aggiunta
- 3.3 Alogenazione
- 3.4 Cracking
- 4 tipi
- 5 Usi
- 6 esempi
- 7 Riferimenti
Proprietà degli idrocarburi alifatici
Le proprietà degli idrocarburi alifatici variano in misura diversa a seconda di quelli considerati. Ci sono quelli di massa molecolare bassa e alta, così come lineari, ramificati, ciclici o policiclici, anche quelli con strutture tridimensionali sorprendenti; come con il cubano, a forma di cubo.
Tuttavia, ci sono alcune generalità che possono essere menzionate. La maggior parte degli idrocarburi alifatici sono gas o liquidi idrofobici e apolari, alcuni più apolari di altri, poiché sono inclusi anche quelli nelle cui catene di carbonio contengono atomi di alogeno, ossigeno, azoto o zolfo..
Allo stesso modo, sono composti infiammabili, poiché sono suscettibili all'ossidazione nell'aria con una minima fonte di calore. Questa caratteristica diventa più pericolosa se si aggiunge la sua elevata volatilità, a causa delle deboli interazioni dispersive che tengono insieme le molecole alifatiche..
Lo vediamo ad esempio nel butano, un gas che può liquefare in modo relativamente facile come il propano. Entrambi sono altamente volatili e infiammabili, rendendoli componenti attivi nel gas da cucina o negli accendini tascabili..
Naturalmente, questa volatilità tende a diminuire all'aumentare della massa molecolare e l'idrocarburo produce liquidi sempre più viscosi e oleosi..
Nomenclatura
La nomenclatura degli idrocarburi differisce anche più delle loro proprietà. Se sono alcani, alcheni o alchini, vengono seguite le stesse regole stabilite dalla IUPAC: selezionare la catena più lunga, assegnando i numeri degli indicatori più bassi all'estremità più sostituita o agli eteroatomi o gruppi più reattivi.
In questo modo si sa su quale carbonio si trova ciascun sostituente, o anche le insaturazioni (doppi o tripli legami). Nel caso degli idrocarburi ciclici, il nome è preceduto dai sostituenti elencati in ordine alfabetico, seguito dalla parola "ciclo", contando i numeri di carbonio che lo compongono..
Ad esempio, considera i seguenti due cicloesani:
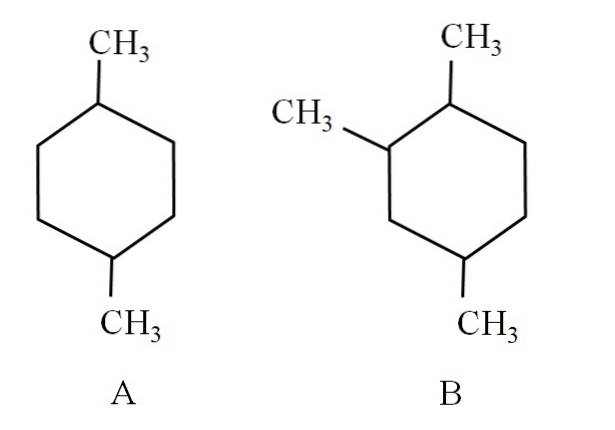
Il cicloesano A è chiamato 1,4-dimetilcicloesano. Se l'anello fosse di cinque atomi di carbonio, sarebbe 1,4-dimetilciclopentano. Nel frattempo, il cicloesano B è chiamato 1,2,4-trimetilcicloesano e non 1,4,6-cicloesano, poiché cerca di utilizzare gli indicatori più bassi.
Ora, la nomenclatura può diventare molto complicata per gli idrocarburi con strutture bizzarre. Per loro ci sono regole più specifiche, che devono essere spiegate separatamente e con attenzione; come con dieni, terpeni, polieni e composti policiclici.
Reazioni
Combustione
Fortunatamente, le reazioni sono meno varie per questi idrocarburi. Uno di questi è già stato menzionato: bruciano facilmente, producendo anidride carbonica e acqua, oltre ad altri ossidi o gas a seconda della presenza di eteroatomi (Cl, N, P, O, ecc.). Tuttavia, il CODue e H.DueOppure sono i principali prodotti della combustione.
Aggiunta
Se presentano insaturazioni possono subire reazioni di addizione; cioè, incorporano piccole molecole nella loro spina dorsale come sostituenti seguendo un meccanismo specifico. Tra queste molecole abbiamo l'acqua, l'idrogeno e gli alogeni (FDue, ClDue, BrDue e ioDue).
Alogenazione
D'altra parte, gli idrocarburi alifatici sotto l'incidenza della radiazione ultravioletta (hv) e il calore può rompere i legami C-H per scambiarli con legami C-X (C-F, C-Cl, ecc.). Questa è la reazione di alogenazione, che si osserva negli alcani a catena molto corta, come il metano o il pentano..
Cracking
Un'altra reazione a cui possono subire gli idrocarburi alifatici, in particolare gli alcani a catena lunga, è il cracking termico. Consiste nella fornitura di calore intenso in modo che l'energia termica rompa i legami C-C, e quindi si formano piccole molecole, più apprezzate nel mercato dei combustibili, da grandi molecole.
Le quattro reazioni di cui sopra sono le principali che può subire un idrocarburo alifatico, di cui la combustione è la più importante, poiché non discrimina alcun composto; tutto brucerà in presenza di ossigeno, ma non tutti aggiungeranno molecole o si scompongono in piccole molecole.
Tipi
Gli idrocarburi alifatici raggruppano un numero infinito di composti, che a loro volta vengono classificati in modo più specifico, indicando il grado della loro insaturazione, nonché il tipo di struttura che hanno..
A seconda di quanto sono insaturi, abbiamo alcani (saturi), alcheni e alchini (insaturi).
Gli alcani sono caratterizzati dall'avere legami C-C singoli, mentre negli alcheni e negli alchini osserviamo rispettivamente i legami C = C e C≡C. Un modo molto generale per visualizzarli è pensare agli scheletri di carbonio degli alcani come catene a zigzag e piegate, essendo "quadrati" per gli alcheni e "linee rette" per gli alchini.
Ciò è dovuto al fatto che i doppi e tripli legami presentano energia e restrizione sterica nelle loro rotazioni, "indurendone" le strutture..
Alcani, alcheni e alchini possono essere ramificati, ciclici o policiclici. Questo è il motivo per cui cicloalcani, cicloalcheni, cicloalchine e composti come decalina (struttura biciclo), adamantano (simile a un berretto da baseball), eptalene, gonano, tra gli altri, sono anche considerati idrocarburi alifatici..
Altri tipi di idrocarburi derivano da alcheni, come dieni (con due doppi legami), polieni (con molti doppi legami alternati) e terpeni (composti derivati da isoprene, un diene).
Applicazioni
Anche in questo caso, gli usi di questi idrocarburi possono variare a seconda di quale viene considerato. Tuttavia, nelle sezioni delle proprietà e delle reazioni è stato chiarito che tutti bruciano, non solo per rilasciare molecole gassose, ma anche luce e calore. Sono quindi serbatoi di energia, utili per servire come combustibili o fonti di calore..
Ecco perché vengono utilizzati come parte della composizione della benzina, per il gas naturale, nei becchi Bunsen e in generale per poter accendere fuochi..
Uno degli esempi più notevoli è quello dell'acetilene, HC≡CH, la cui combustione consente di eccitare gli ioni metallici di un campione nella spettrometria di assorbimento atomico effettuata in prove analitiche. Inoltre, il fuoco risultante può essere utilizzato per la saldatura.
Gli idrocarburi alifatici liquidi, come i paraffinici, sono spesso usati come solventi per l'estrazione dei grassi. Inoltre, la sua azione solvente può essere utilizzata per rimuovere macchie, smalti, pitture o semplicemente per preparare soluzioni di un determinato composto organico.
Quelli con la più alta massa molecolare, siano essi viscosi o solidi, sono utilizzati per la produzione di resine, polimeri o medicinali.
Per quanto riguarda il termine "alifatico", è spesso usato per riferirsi a quelle regioni, in una macromolecola, prive di aromaticità. Ad esempio, gli asfalteni sono descritti superficialmente come un nucleo aromatico con catene alifatiche.
Esempi
All'inizio si diceva che il metano è il più semplice degli idrocarburi alifatici. È seguito da propano, CH3CHDueCH3, butano, CH3CHDueCHDueCH3, pentano, CH3CHDueCHDueCHDueCH3, ottano, nonano, decano e così via, con alcani sempre più lunghi.
Lo stesso vale per l'etilene, CHDue= CHDue, propene, CH3CH = CHDue, butene, CH3CHDueCH = CH3, e per il resto degli alchini. Se ci sono due doppi legami, sono dieni e se ce ne sono più di due, polieni. Allo stesso modo, possono esserci doppi e tripli legami nello stesso scheletro, aumentando la complessità strutturale..
Tra i cicloalcani possiamo citare ciclopropano, ciclobutano, ciclopentano, cicloesano, cicloeptano, cicloottano, oltre a cicloesene e cicloesina. Da tutti questi idrocarburi si ottengono a loro volta derivati ramificati, moltiplicando ulteriormente gli esempi disponibili (come 1,4-dimetilcicloesano).
Tra i terpeni più rappresentativi abbiamo il limonene, il mentolo, il pinene, la vitamina A, lo squalene, ecc. Il polietilene è un polimero saturo di unità -CHDue-CHDue-, quindi è anche un esempio di questi idrocarburi. Altri esempi sono già stati citati nelle sezioni precedenti.
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Helmenstine, Anne Marie, Ph.D. (22 agosto 2019). Definizione di idrocarburo alifatico. Estratto da: thoughtco.com
- Wikipedia. (2019). Composto alifatico. Estratto da: en.wikipedia.org
- Chemistry LibreTexts. (20 agosto 2019). Idrocarburi alifatici. Recupero da: chem.libretexts.org
- Elizabeth Wyman. (2019). Idrocarburi alifatici: definizione e proprietà. Studia. Estratto da: study.com



Nessun utente ha ancora commentato questo articolo.