
Formula minima come ottenere la formula minima, esempi ed esercizi
Il formula minima o empirica È un'espressione della proporzione in cui sono presenti gli atomi dei diversi elementi che compongono un composto chimico. La formula minima è quindi la rappresentazione più semplice di un composto chimico. Questo è il motivo per cui è 'minimale'.
La formula minima non esprime il numero di atomi dei diversi elementi che compongono un composto chimico; ma la proporzione in cui questi atomi si combinano per generare il composto chimico.
La formula minima è anche chiamata formula empirica, poiché è ottenuta dalla sperimentazione; cioè, è correlato all'esperienza. L'osservazione sperimentale ha permesso di concludere che due atomi di idrogeno si combinano con un atomo di idrogeno per formare acqua (H.DueO).
In molti casi, la formula minima corrisponde alla formula molecolare. Nel molecolare compaiono i numeri reali dei diversi elementi che compongono un composto chimico; tale è il caso, ad esempio, dell'acido solforico (H.DueSW4).
Ma in altri casi, non c'è coincidenza tra la formula minima e la formula molecolare; Questo è il caso del benzene: la formula minima è CH, mentre la sua formula molecolare è C6H6.
Indice articolo
- 1 Come ottenere la formula minima?
- 1.1 Primo passo
- 1.2 Seconda fase
- 1.3 Terzo passaggio
- 1.4 Quarta fase
- 2 Esempi di formula minima
- 2.1 Acqua e anidride carbonica
- 2.2 Ossidi basici e acidi
- 2.3 Acido acetico
- 2.4 Acido butirrico
- 2.5 Glicole etilenico
- 2.6 Benzene
- 2.7 Glucosio
- 3 esercizi risolti
- 3.1 - Esercizio 1
- 3.2 - Esercizio 2
- 4 Riferimenti
Come ottenere la formula minima?
Primo passo
Trova i grammi di ogni elemento presente nel composto. Essendo solitamente espresse come percentuale della massa del composto, è necessario fare un semplice calcolo per la trasformazione delle percentuali di massa in massa degli elementi.
Secondo passo
Si ottiene il numero relativo di atomi dei diversi elementi che compongono il composto chimico. Per fare ciò, la massa di ciascun elemento, espressa in grammi, viene divisa per la sua massa atomica.
Alcuni autori preferiscono chiamare il numero relativo di atomi, come il numero di moli di atomi degli elementi che fanno parte del composto chimico.
Terzo passaggio
Ottenere la proporzione minima, espressa in numeri interi, di ciascuno degli atomi presenti nel composto chimico.
Per trovare questi valori, dividere i numeri relativi di ciascun atomo presente nel composto per il valore numerico relativo minimo che un atomo ha nel composto chimico..
Nel caso in cui il valore della proporzione minima di un atomo non sia un numero intero senza decimali, tutti i valori della proporzione minima devono essere moltiplicati per un numero; in modo tale che tutti i valori della proporzione minima siano numeri interi.
Ad esempio, se il valore della proporzione minima di un atomo del composto chimico è 2,5, moltiplicare tutti i valori della proporzione minima di ciascuno degli atomi presenti volte 2. Quindi, tutti i valori della proporzione minima saranno solo numeri interi.
Quarto passo
Scrivi la formula minima del composto. I valori della proporzione minima per gli atomi dei diversi elementi verranno posti come pedici dei simboli chimici degli elementi per scrivere la formula minima.
Esempi di formule minime
Acqua e anidride carbonica
La maggior parte dei composti chimici ha formule che sono sia formule minime che molecolari. Pertanto, la formula per l'acqua (H.DueO) è una formula minima; ma è anche una formula molecolare. Lo stesso vale per la formula dell'anidride carbonica (CODue).
Ossidi basici e acidi
Gli ossidi di base e acidi sono composti chimici che hanno formule chimiche, con poche eccezioni che sono sia formule minime che molecolari. La stessa situazione si verifica con idrossidi e acidi, ad eccezione di alcuni acidi carbossilici..
Acido acetico
Gli acidi carbossilici che hanno un numero pari di atomi di carbonio nella loro composizione hanno, separatamente, una formula minima e una formula molecolare. L'acido acetico, ad esempio, ha una formula molecolare (CDueH4ODue); ma ha anche una formula minima (CHDueO).
Acido butirrico
L'acido butirrico ha anche una formula molecolare (C.4H8ODue) e una formula minima (CDueH4O).
Glicole etilenico
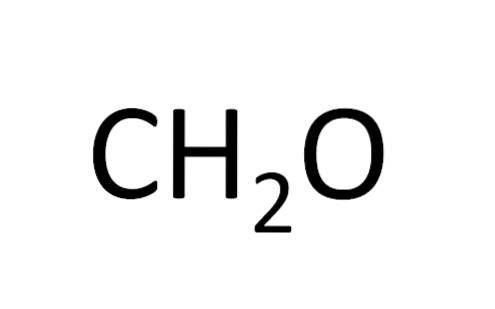
Altri composti organici hanno entrambi i tipi di formule chimiche; è il caso del glicole etilenico, che ha una formula molecolare (CDueH6ODue) e una formula minima (CH3O).
Benzene
Il benzene, un composto aromatico, ha una formula molecolare (C.6H6) e una formula minima (CH).
Glucosio
Il glucosio ha una formula molecolare (C6H12O6) e una formula minima (CHDueO).
Esercizi risolti
- Esercizio 1
Il glicole etilenico è un composto utilizzato come antigelo, ha un peso molecolare di 62,1 g / mol e una composizione percentuale in massa come segue:
C: 38%,
H: 9,7%
Oppure: 51,16%.
Primo passo
Esprimi le percentuali di massa degli elementi nelle loro masse in grammi. Per questo si prende come riferimento il peso molecolare del glicole etilenico. Se questo è 62,1 grammi per mole, il 38% è costituito da carbonio. E così via con gli altri elementi:
Massa di carbonio = 62,1 g (38/100)
= 23,6 g
Massa di idrogeno = 62,1 g (9,7 / 100)
= 6,024 g
Massa di ossigeno = 62,1 g (51,16 / 100)
= 31,77 g
Secondo passo
Calcola il numero relativo di ogni atomo presente (NRA) o il numero di moli di ogni atomo. Per fare ciò, la massa di ogni elemento chimico viene divisa per la sua massa atomica.
NRA (C) = 23,6 g / 12 g
= 1,97
Può essere arrotondato a 2.
NRA (H) = 6,024 g / 1 g
= 6,024
Può essere arrotondato a 6.
NRA (O) = 31,77 g / 16 g
= 1.985
Può essere arrotondato a 2.
Terzo passaggio
Calcola il rapporto intero minimo degli elementi del composto (PMNE). Per fare ciò, dividi ciascuno dei valori dei numeri relativi atomici (NRA) per il valore più piccolo di questo. In questo caso, 2.
PMNE (C) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMNE (O) = 2/2
= 1
Quarto passo
Scrivi la formula minima per il glicole etilenico:
CH3O
Come si può vedere, i valori ottenuti nella fase 3 sono i pedici degli elementi del composto.
- Esercizio 2
L'acido acetico ha un peso molecolare di 60 g / mol e la seguente composizione percentuale in massa:
C: 40%
H: 6,67%
Oppure: 53,33%
Ottieni la formula minima del composto.
Primo passo
Trasforma le percentuali di massa degli elementi nelle loro masse espresse in grammi:
Massa di carbonio = 60 g (40/100)
= 24 g
Massa di idrogeno = 60 g (6,67 / 100)
= 4 g
Massa di ossigeno = 60 g (53,33 / 100)
= 32 g
Secondo passo
Calcola il numero relativo di atomi (NRA) del composto. Per fare ciò, le masse degli elementi sono divise per le loro masse atomiche:
NRA (C) = 24 g / 12 g
= 2
NRA (H) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Terzo passaggio
Ottieni il rapporto numero intero minimo degli elementi del composto (PMNE). A tale scopo, i valori NRA degli elementi vengono divisi per il valore NRA più basso di un elemento:
PMNE (C) = 2/2
= 1
PMNE (H) = 4/2
= 2
PMNE (O) = 2/2
= 1
Quarto passo
Scrivi la formula minima per l'acido acetico:
CHDueO
I pedici del composto sono i valori ottenuti da PMNE.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Helmenstine, Anne Marie, Ph.D. (27 agosto 2019). Formula empirica: definizione ed esempi. Estratto da: thoughtco.com
- Wikipedia. (2020). Formula empirica. Estratto da: en.wikipedia.org
- Chemistry LibreTexts. (03 luglio 2019). Calcolo di formule empiriche per composti. Recupero da: chem.libretexts.org
- Nicola McDougal. (2020). Formula empirica: definizione, passaggi ed esempi. Studia. Estratto da: study.com


Nessun utente ha ancora commentato questo articolo.