
Struttura, proprietà e usi del fosfato di calcio (Ca3 (PO4) 2)

Il fosfato di calcio è un sale inorganico e terziario la cui formula chimica è Ca3(PO4)Due. La formula afferma che la composizione di questo sale è 3: 2 per calcio e fosfato, rispettivamente. Questo può essere visto direttamente nell'immagine sottostante, dove è mostrato il catione Ca.Due+ e l'anione PO43-. Per ogni tre CaDue+ ci sono due PO43- interagendo con loro.
D'altra parte, il fosfato di calcio si riferisce a una serie di sali che variano a seconda del rapporto Ca / P, nonché del grado di idratazione e del pH. In effetti, esistono molti tipi di fosfati di calcio che possono essere sintetizzati. Tuttavia, seguendo la nomenclatura alla lettera, il fosfato di calcio si riferisce solo al tricalcio, il suddetto.

Tutti i fosfati di calcio, compreso il Ca3(PO4)Due, sono di colore bianco pieno con lievi sfumature grigiastre. Possono essere granulari, fini, cristallini e avere dimensioni delle particelle di circa micron; e sono state preparate anche nanoparticelle di questi fosfati, con cui sono progettati materiali biocompatibili per le ossa.
Questa biocompatibilità è dovuta al fatto che questi sali si trovano nei denti e, in breve, nei tessuti ossei dei mammiferi. Ad esempio, l'idrossiapatite è un fosfato di calcio cristallino, che a sua volta interagisce con una fase amorfa dello stesso sale..
Ciò significa che sono presenti fosfati di calcio amorfi e cristallini. Per questo motivo non sorprende la diversità e le molteplici opzioni quando si sintetizzano materiali a base di fosfati di calcio; materiali nelle cui proprietà ogni giorno più ricercatori sono interessati in tutto il mondo a concentrarsi sul restauro delle ossa.
Indice articolo
- 1 Struttura del fosfato di calcio
- 1.1 Fosfato di calcio amorfo
- 1.2 Il resto della famiglia
- 2 Proprietà fisiche e chimiche
- 2.1 Nomi
- 2.2 Peso molecolare
- 2.3 Descrizione fisica
- 2.4 Aroma
- 2.5 Punto di fusione
- 2.6 Solubilità
- 2.7 Densità
- 2.8 Indice di rifrazione
- 2.9 Entalpia standard di formazione
- 2.10 Temperatura di conservazione
- 2.11 pH
- 3 Formazione
- 3.1 Nitrato di calcio e fosfato di ammonio idrogeno
- 3.2 Idrossido di calcio e acido fosforico
- 4 Usi
- 4.1 Nel tessuto osseo
- 4.2 Cementi bioceramici
- 4.3 Medici
- 4.4 Altri
- 5 Riferimenti
Struttura del fosfato di calcio
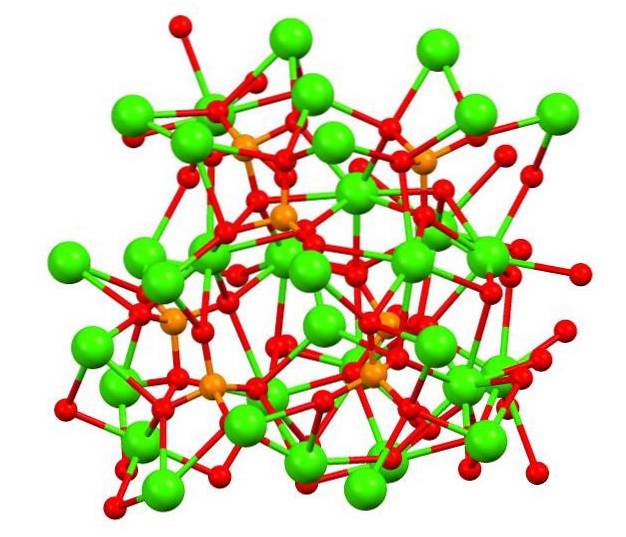
L'immagine in alto mostra la struttura del fosfato di calico tribasico nello strano minerale whitlockite, che può contenere magnesio e ferro come impurità..
Sebbene a prima vista possa sembrare complesso, è necessario chiarire che il modello ipotizza interazioni covalenti tra gli atomi di ossigeno dei fosfati ei centri metallici del calcio..
A titolo di rappresentazione vale, invece, che le interazioni siano elettrostatiche; cioè i cationi CaDue+ sono attratti dagli anioni PO43- (ACDue+- O-PO33-). Con questo in mente, si capisce perché nell'immagine il calcio (sfere verdi) è circondato dagli atomi di ossigeno caricati negativamente (sfere rosse).
Poiché ci sono così tanti ioni, non lascia una disposizione o un motivo simmetrico visibile. Il CA3(PO4)Due adotta a basse temperature (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)Due (β-TCP).
Ad alte temperature, invece, si trasforma nel polimorfo α-Ca3(PO4)Due (α-TCP), la cui cella unitaria corrisponde a un sistema cristallino monoclino. A temperature ancora più elevate, può formarsi anche il polimorfo α'-Ca.3(PO4)Due, che è di struttura cristallina esagonale.
Fosfato di calcio amorfo
Sono state menzionate strutture cristalline per il fosfato di calcio, che ci si può aspettare da un sale. È però in grado di esibire strutture disordinate e asimmetriche, legate più a una tipologia di “vetro fosfato di calcio” che a cristalli nel senso stretto della sua definizione..
Quando ciò si verifica, si dice che il fosfato di calcio abbia una struttura amorfa (ACP, fosfato di calcio amorfo). Diversi autori indicano questo tipo di struttura come responsabile delle proprietà biologiche del Ca3(PO4)Due nei tessuti ossei, essendo possibile la sua riparazione e biomimetizzazione.
Chiarendo la sua struttura mediante risonanza magnetica nucleare (NMR), è stata trovata la presenza di ioni OH- e HPO4Due- negli ACP. Questi ioni sono formati dall'idrolisi di uno dei fosfati:
PO43- + HDueO <=> HPO4Due- + Oh-
Di conseguenza, la vera struttura di ACP diventa più complessa, la cui composizione dei suoi ioni è rappresentata dalla formula: Ca9(PO4)6-x(HPO4)X(OH)X. La 'x' indica il grado di idratazione, poiché se x = 1, la formula sarebbe come: Ca9(PO4)5(HPO4) (OH).
Le diverse strutture che ACP possono avere dipendono dai rapporti molari Ca / P; cioè delle quantità relative di calcio e fosfato, che cambiano la loro intera composizione risultante.
Il resto della famiglia
I fosfati di calcio sono infatti una famiglia di composti inorganici, che a loro volta possono interagire con una matrice organica.
Gli altri fosfati si ottengono "semplicemente" cambiando gli anioni che accompagnano il calcio (PO43-, HPO4Due-, HDuePO4-, Oh-), nonché il tipo di impurità nel solido. Pertanto, fino a undici fosfati di calcio o più, ciascuno con la propria struttura e proprietà, possono essere originati in modo naturale o artificiale..
Di seguito verranno menzionati alcuni fosfati e le rispettive strutture chimiche e formule:
-Calcio idrogenofosfato diidrato, CaHPO4∙ 2HDueO: monoclino.
-Calcio diidrogeno fosfato monoidrato, Ca (H.DuePO4)Due∙ H.DueOppure: triclino.
-Fosfato diacido anidro, Ca (H.DuePO4)Due: triclino.
-Ottacalcio idrogenofosfato (OCP), Ca8HDue(PO4)6: triclino. È un precursore nella sintesi dell'idrossiapatite.
-Idrossiapatite, Ca5(PO4)3OH: esagonale.
Proprietà fisiche e chimiche
Nomi
-Fosfato di calcio
-Fosfato tricalcico
-Difosfato tricalcico
Peso molecolare
310,74 g / mol.
Descrizione fisica
È un solido bianco inodore.
Gusto
Insapore.
Punto di fusione
1670 ºK (1391 ºC).
Solubilità
-Praticamente insolubile in acqua.
-Insolubile in etanolo.
-Solubile in acido cloridrico diluito e acido nitrico.
Densità
3,14 g / cm3.
Indice di rifrazione
1.629
Entalpia di formazione standard
4126 kcal / mol.
Temperatura di conservazione
2-8 ºC.
pH
6-8 in una sospensione acquosa di 50 g / L di fosfato di calcio.
Formazione
Nitrato di calcio e fosfato di ammonio idrogeno
Esistono numerosi metodi per produrre o formare fosfato di calcio. Uno di questi è costituito da una miscela di due sali, Ca (NO3)Due∙ 4HDueO e (NH4)DueHPO4, precedentemente sciolto in alcool assoluto e acqua, rispettivamente. Un sale fornisce calcio e l'altro fosfato.
Da questa miscela precipita l'ACP, che viene poi sottoposto a riscaldamento in forno a 800 ° C per 2 ore. Come risultato di questa procedura, si ottiene il β-Ca3(PO4)Due. Controllando attentamente temperature, agitazione e tempi di contatto, può verificarsi la formazione di nanocristalli.
Per formare il polimorfo α-Ca3(PO4)Due è necessario riscaldare il fosfato oltre i 1000 ° C. Questo riscaldamento viene effettuato in presenza di altri ioni metallici, che stabilizzano sufficientemente questo polimorfo da poter essere utilizzato a temperatura ambiente; cioè, rimane in un meta stato stabile.
Idrossido di calcio e acido fosforico
Il fosfato di calcio può anche essere formato mescolando le soluzioni di idrossido di calcio e acido fosforico, producendo una neutralizzazione acido-base. Dopo mezza giornata di maturazione nelle acque madri, e la loro dovuta filtrazione, lavaggio, essiccazione e setacciatura, si ottiene una polvere di fosfato amorfo granulare ACP..
Questo prodotto di reazioni ACP di alte temperature, trasformandosi secondo le seguenti equazioni chimiche:
2Ca9(HPO4) (PO4)5(OH) => 2Ca9(PDueO7)0,5(PO4)5(OH) + HDueO (a T = 446,60 ° C)
2Ca9(PDueO7)0,5(PO4)5(OH) => 3Ca3(PO4)Due + 0.5HDueO (a T = 748,56 ° C)
In questo modo si ottiene il β-Ca3(PO4)Due, il suo polimorfo più comune e stabile.
Applicazioni
Nel tessuto osseo
Il CA3(PO4)Due è il principale costituente inorganico delle ceneri ossee. È un componente dei trapianti di sostituzione ossea, questo è spiegato dalla sua somiglianza chimica con i minerali presenti nell'osso.
I biomateriali di fosfato di calcio sono utilizzati per correggere i difetti ossei e nel rivestimento delle protesi metalliche in titanio. Su di essi si deposita fosfato di calcio, isolandoli dall'ambiente e rallentando il processo di corrosione del titanio..
Fosfati di calcio, compreso Ca3(PO4)Due, Sono usati per realizzare materiali ceramici. Questi materiali sono biocompatibili e sono attualmente utilizzati per ripristinare la perdita di osso alveolare derivante da malattia parodontale, infezioni endodontiche e altre condizioni..
Tuttavia, dovrebbero essere utilizzati solo per accelerare la riparazione ossea periapicale, in aree in cui non è presente un'infezione batterica cronica..
Il fosfato di calcio può essere utilizzato per riparare i difetti ossei quando non è possibile utilizzare un innesto osseo autologo. Può essere utilizzato da solo o in combinazione con un polimero biodegradabile e riassorbibile, come l'acido poliglicolico.
Cementi bioceramici
Il cemento fosfato di calcio (CPC) è un altro bioceramico utilizzato nella riparazione del tessuto osseo. Si ottiene mescolando la polvere di diversi tipi di fosfati di calcio con l'acqua, formando una pasta. La pasta può essere iniettata o adattata al difetto osseo o alla cavità.
I cementi vengono modellati, riassorbiti gradualmente e sostituiti da osso neoformato.
Medici
-Il CA3(PO4)Due È un sale basico, quindi viene utilizzato come antiacido per neutralizzare il bruciore di stomaco in eccesso e aumentare il pH. Nei dentifrici fornisce una fonte di calcio e fosfato per facilitare il processo di remineralizzazione dei denti e l'emostasi ossea.
-Viene anche usato come integratore alimentare, sebbene il modo più economico per fornire calcio sia usare il suo carbonato e citrato..
-Il fosfato di calcio può essere utilizzato nel trattamento della tetania, dell'ipocalcemia latente e della terapia di mantenimento. Inoltre, è utile nell'integrazione di calcio durante la gravidanza e l'allattamento..
-Viene utilizzato nel trattamento della contaminazione con isotopi radioattivi del radio (Ra-226) e dello stronzio (Sr-90). Il fosfato di calcio blocca l'assorbimento degli isotopi radioattivi nel tratto digerente, limitando così i danni da essi causati.
Altri
-Il fosfato di calcio è usato come mangime per gli uccelli. Inoltre, viene utilizzato nei dentifrici per controllare il tartaro..
-Viene utilizzato come agente antiagglomerante, ad esempio per impedire la compattazione del sale da cucina.
-Funziona come agente sbiancante per la farina. Nel frattempo, nello strutto previene colorazioni indesiderate e migliora le condizioni di frittura..
Riferimenti
- Tung M.S. (1998) Fosfati di calcio: struttura, composizione, solubilità e stabilità. In: Amjad Z. (a cura di) Fosfati di calcio nei sistemi biologici e industriali. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu e Honglian Dai. (2018). "Synthesis, Characterization of Nano-β-Tricalcium Phosphate and the Inhibition on Hepatocellular Carcinoma Cells", Journal of Nanomaterials, vol. 2018, ID articolo 7083416, 7 pagine, 2018.
- Combes, Christ e Rey, Christian. (2010). Fosfati di calcio amorfi: sintesi, proprietà e usi nei biomateriali. Acta Biomaterialia, vol. 6 (n ° 9). pp. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Fosfato tricalcico. Estratto da: en.wikipedia.org
- Abida et al. (2017). Fosfato tricalcico in polvere: capacità di preparazione, caratterizzazione e compattazione. Mediterranean Journal of Chemistry 2017, 6 (3), 71-76.
- PubChem. (2019). Fosfato di calcio. Estratto da: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Fosfato di calcio. Science Direct. Estratto da: sciencedirect.com



Nessun utente ha ancora commentato questo articolo.