
Struttura, proprietà, produzione, usi del fosfato di alluminio (AlPO4)

Il fosfato di alluminio è un solido inorganico formato da uno ione alluminio Al3+ e uno ione fosfato PO43-. La sua formula chimica è AlPO4. È un solido bianco la cui struttura cristallina è simile a quella della silice SiODue. È insolubile in acqua.
Può essere ottenuto da allumina (AlDueO3) e acido fosforico (H3PO4). Può essere ottenuto anche a partire da soluzioni acquose di cloruro di alluminio (AlCl3) e fosfato di sodio (Na3PO4).

Il fosfato di alluminio ha un punto di fusione molto alto, motivo per cui è ampiamente utilizzato come componente di ceramiche refrattarie, cioè ceramiche che resistono a temperature molto elevate..
Viene anche usato come antiacido per lo stomaco, in miscele per la riparazione dei denti e come coadiuvante ai vaccini, cioè per stimolare la risposta immunitaria dell'organismo.
Alcuni calcestruzzi refrattari hanno AlPO4 nella sua composizione, che aumenta le proprietà di supporto meccanico e alle alte temperature di questo tipo di cemento.
È stato utilizzato come scudo protettivo per impedire la combustione di materiali combustibili come alcuni polimeri.
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Densità
- 3.5 Solubilità
- 3.6 Altre proprietà
- 4 Ottenimento
- 5 Utilizzo in ceramica
- 5.1 Fabbricazione di ceramiche di fosfato di alluminio
- 6 Altri usi
- 6.1 Nell'ottenere il calcestruzzo
- 6.2 Nei cementi dentali
- 6.3 Nei vaccini
- 6.4 Come ritardante di fiamma nei polimeri
- 7 Riferimenti
Struttura
L'AlPO4 È formato da un catione di alluminio Al3+ e un anione fosfato PO43-.
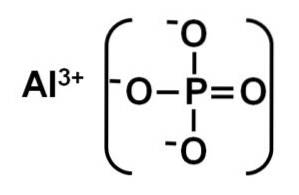
Il fosfato di alluminio cristallino è anche chiamato berlinite o fase alfa (α-AlPO4) ei suoi cristalli sono simili al quarzo.

La fase alfa del fosfato di alluminio è un solido formato da una rete covalente di tetraedri PO4 e AlPO4 che si alternano e sono collegati da atomi di ossigeno.
Questa struttura è isomorfa con la silice, cioè ha la stessa forma di quella della silice SiODue.
Nomenclatura
- Fosfato di alluminio
- Monofosfato di alluminio
- Sale di alluminio dell'acido fosforico.
Proprietà
Stato fisico
Solido bianco cristallino.
Peso molecolare
121,93 g / mol
Punto di fusione
1800 ºC
Densità
2,56 g / cm3
Solubilità
Insolubile in acqua
Altre proprietà
La struttura dell'AlPO4 è molto simile alla silice SiODue, quindi condivide molte proprietà fisiche e chimiche di questo.
Il fosfato di alluminio è un materiale altamente refrattario, cioè resiste a temperature molto elevate senza cambiare il proprio stato fisico o struttura e senza decomporsi.
L'AlPO4 cristallino o berlinite quando riscaldato si converte in una struttura di tipo tridimite e quindi di tipo cristobalite, altre forme di questo composto che assomigliano a silice SiODue.

Ottenere
Fosfato di alluminio AlPO4 può essere ottenuto dalla reazione tra acido fosforico H3PO4 e allumina AlDueO3. È richiesta l'applicazione della temperatura, ad esempio tra 100 e 150 ° C.
AlDueO3 + 2 h3PO4 = 2 AlPO4 + 3 oreDueO
Può anche essere ottenuto unendo una soluzione acquosa di cloruro di alluminio AlCl3 con una soluzione acquosa di fosfato di sodio Na3PO4:
AlCl3 + N / A3PO4 = AlPO4 + 3 NaCl
Utilizzare in ceramica
Fosfato di alluminio AlPO4 si trova spesso nella costituzione di allumina ceramica.
La ceramica ad alto contenuto di allumina è uno dei materiali che, per la sua durezza, trova impiego in applicazioni dove è richiesta la resistenza a carichi elevati e condizioni severe..
Questo tipo di ceramica è resistente alla corrosione, agli ambienti ad alta temperatura, alla presenza di vapore caldo o ad atmosfere riducenti come il monossido di carbonio (CO)..
La ceramica di allumina ha anche una bassa conduttività elettrica e termica, motivo per cui viene utilizzata per realizzare mattoni refrattari e componenti elettricamente isolanti..

Perché il fosfato di alluminio si forma a una temperatura molto più bassa della silice SiODue, la sua produzione è più economica, il che costituisce un vantaggio nella produzione di ceramiche adatte a servizi esigenti.
Produzione di ceramiche in fosfato di alluminio
Viene utilizzata alluminaDueO3 e acido fosforico H3PO4 in mezzo acquoso.
Il pH di formazione preferito è 2-8, poiché vi è un'abbondanza di specie di acido fosforico disciolto, come HDuePO4- e HPO4Due-. A pH acido la concentrazione di ioni Al3+ è elevato, derivante dalla dissoluzione dell'allumina AlDueO3.
In primo luogo, si forma un gel idrato di alluminio difosfato triidrogeno AlH.3(PO4)Due.HDueO:
Al3+ + HDuePO4- + HPO4Due- + HDueO ⇔ AlH3(PO4)3.HDueO
Tuttavia, arriva un momento in cui il pH della soluzione scende e diventa neutro, dove l'allumina AlDueO3 ha una bassa solubilità. A questo punto, l'allumina insolubile forma uno strato sulla superficie delle particelle, impedendo il proseguimento della reazione..
Pertanto è necessario aumentare la solubilità dell'allumina e ciò si ottiene riscaldando delicatamente. Al riscaldamento a 150 ° C il gel continua la reazione con allumina AlDueO3 rilasciando acqua e berlinite cristallina (alfa-AlPO4).
AlDueO3 + 2 AlH3(PO4)3.HDueO → AlPO4 + 4 hDueO
La berlinite lega le singole particelle e forma la ceramica.
Altri usi
L'AlPO4 Viene utilizzato come antiacido, come adsorbente, come setaccio molecolare, come supporto catalizzatore e come rivestimento per migliorare la resistenza alla corrosione a caldo. Di seguito altre applicazioni.
Nell'ottenere il calcestruzzo
Il fosfato di alluminio è un ingrediente nei calcestruzzi refrattari o nei calcestruzzi resistenti al calore.
Fornisce eccellenti proprietà meccaniche e rifrangenti a questi calcestruzzi, come la resistenza al calore. Nell'intervallo di temperatura tra 1400-1600 ° C, il cemento cellulare a base di fosfato di alluminio è uno dei materiali più efficienti come isolante termico..
Non necessita di essiccazione, il suo indurimento è ottenuto mediante una reazione esotermica auto-propagante. È possibile preparare mattoni di questo materiale di qualsiasi forma e dimensione.
Nei cementi dentali
Il fosfato di alluminio fa parte dei cementi dentali o dei materiali utilizzati per curare i denti cariati.
Nei cementi dentali l'allumina viene utilizzata come moderatore delle reazioni acido-base, dove l'effetto moderatore è dovuto alla formazione di fosfato di alluminio sulle particelle di altri materiali..
Questi cementi hanno un'elevatissima resistenza alla compressione e alla trazione, dovuta alla presenza di fosfato di alluminio.
Nei vaccini
L'AlPO4 È stato utilizzato per molti anni in vari vaccini umani per migliorare la risposta immunitaria del corpo. Si dice che l'AlPO4 è un "coadiuvante" per i vaccini. Il meccanismo non è ancora ben compreso.
È noto che l'effetto immunostimolante di AlPO4 dipende dal processo di adsorbimento dell'antigene all'adiuvante, cioè dal modo in cui aderisce ad esso. Un antigene è un composto che entrando nel corpo genera la formazione di anticorpi per combattere una specifica malattia.
Gli antigeni possono essere adsorbiti su AlPO4 per interazioni elettrostatiche o legandosi con ligandi. Sono adsorbiti sulla superficie dell'adiuvante.
Si ritiene inoltre che la dimensione delle particelle di AlPO4 ha anche influenza. Più piccola è la dimensione delle particelle, la risposta dell'anticorpo è maggiore e più duratura..
Come ritardante di fiamma nei polimeri
L'AlPO4 È stato utilizzato come ritardante di fiamma e per prevenire la combustione o la combustione di alcuni polimeri.
L'aggiunta di AlPO4 ad un polimero di polipropilene che ha già un ritardante di fiamma provoca un effetto sinergico tra entrambi i ritardanti, il che significa che l'effetto è molto maggiore di quello di entrambi i ritardanti di fiamma separatamente.
Quando il polimero viene sottoposto a combustione o bruciato in presenza di AlPO4, si forma un metafosfato di alluminio che penetra nella superficie carbonizzata e riempie i pori e le fessure di questa.
Ciò porta alla formazione di uno scudo protettivo altamente efficiente per prevenire la combustione o la combustione del polimero. In altre parole l'AlPO4 sigilla la superficie carbonizzata e impedisce al polimero di bruciare.

Riferimenti
- Abyzov, V.A. (2016). Calcestruzzo refrattario leggero a base di legante alluminio-magnesio-fosfato. Procedia Engineering 150 (2016) 1440-1445. Recupero da sciencedirect.com.
- Wagh, A.S. (2016). Ceramica in fosfato di alluminio. In ceramica fosfatica legata chimicamente (seconda edizione). Capitolo 11. Recupero da sciencedirect.com.
- Mei, C. et al. (2019). Adiuvante del vaccino al fosfato di alluminio: analisi della composizione e delle dimensioni utilizzando strumenti offline e in linea. Comput Struct Biotechnol J. 2019; 17: 1184-1194. Recupero da ncbi.nlm.nih.gov.
- Qin, Z. et al. (2019). Effetto barriera sinergico del fosfato di alluminio su polipropilene ritardante di fiamma a base di sistema polifosfato di ammonio / dipentaeritritolo. Materiali e design 181 (2019) 107913. Estratto da sciencedirect.com.
- Vrieling, H. et al. (2019). Nanoparticelle di fosfato di alluminio stabilizzato utilizzate come adiuvante del vaccino. Colloidi e superfici B: Biointerfacce 181 (2019) 648-656. Recupero da sciencedirect.com.
- Schaefer, C. (2007). Farmaci gastrointestinali. Antiacidi. Nei farmaci durante la gravidanza e l'allattamento (seconda edizione). Recupero da sciencedirect.com.
- .



Nessun utente ha ancora commentato questo articolo.