
Entalpia della definizione della reazione, termochimica, esercizi
Il entalpia di reazione è una funzione termodinamica che permette di calcolare il calore guadagnato o erogato in una reazione chimica, a condizione che tale reazione sia avvenuta a pressione costante. È definita come l'energia interna U più il prodotto della pressione P per il volume V delle sostanze che partecipano ad una reazione chimica, come segue: H = U + P ∙ V
Quindi l'entalpia ha dimensioni di energia, e nel Sistema Internazionale di misure viene misurata in Joule. Per comprendere la relazione dell'entalpia con il calore scambiato in una reazione chimica, è necessario ricordare la prima legge della termodinamica, che afferma quanto segue: Q = ΔU + W

La prima legge stabilisce che il calore scambiato in un processo termodinamico è uguale alla variazione dell'energia interna delle sostanze coinvolte nel processo più il lavoro svolto da dette sostanze nel processo..
In ogni processo, il lavoro W è calcolato dalla seguente relazione:
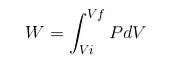
Nell'espressione sopra Vi è il volume iniziale, Vf il volume finale e P la pressione. Se il processo viene eseguito a pressione costante P, il lavoro risultante sarà:
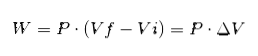
Dove ΔV è la variazione del volume.
Indice articolo
- 1 Definizione
- 2 Rapporto con il calore
- 3 Entalpia standard
- 4 Termochimica
- 4.1 L'entalpia è una grande quantità termodinamica
- 5 Esercizi risolti
- 5.1 -Esercizio 1
- 5.2 -Esercizio 2
- 6 Riferimenti
Definizione
Le reazioni chimiche sono processi termodinamici che generalmente avvengono a pressione costante e molto frequentemente a pressione atmosferica. Questo tipo di processi termodinamici è chiamato "isobarico", poiché avviene a pressione costante.
In questo caso la prima legge della termodinamica può essere scritta così:
Qp = ΔU + P ∙ ΔV
Dove Qp indica che il calore è stato scambiato a pressione costante. Se la definizione di entalpia H = U + P ∙ V è introdotta nell'espressione precedente, si ottiene quindi:
Qp = ΔH
Quindi, una variazione di entalpia positiva indica una reazione che ha assorbito calore dall'ambiente. Questa è una reazione endotermica.
Al contrario, se la variazione di entalpia è negativa, si tratta di una reazione esotermica.
In effetti, la parola entalpia deriva dalla parola greca enthalpien, il cui significato è "riscaldare".
L'entalpia è spesso chiamata anche calore. Ma dovrebbe essere chiaro che non è la stessa cosa del calore, ma è lo scambio di calore durante il processo termodinamico che cambia l'entalpia.
Rapporto con il calore
A differenza del calore, l'entalpia è una funzione dello stato. Quando viene calcolata la variazione di entalpia, viene calcolata la differenza di due funzioni che dipendono esclusivamente dallo stato del sistema, come l'energia interna e il volume..
ΔH = ΔU + P ∙ ΔV
Poiché la pressione rimane costante nella reazione, allora l'entalpia della reazione è una funzione di stato che dipende solo dall'energia interna e dal volume..
In una reazione chimica, l'entalpia dei reagenti può essere definita come la somma di quella di ciascuno di essi; e quella dei prodotti come somma dell'entalpia di tutti i prodotti.
La variazione di entalpia in una reazione è la differenza dei prodotti meno quella dei reagenti:
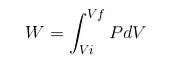
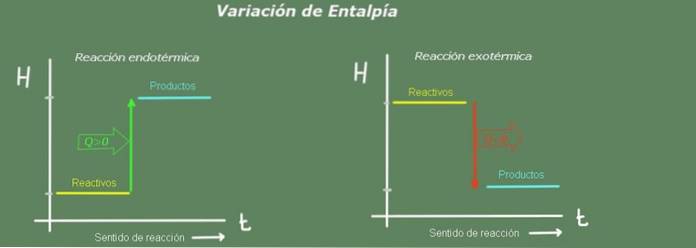
In una reazione endotermica l'entalpia dei prodotti è maggiore di quella dei reagenti; cioè, la reazione prende calore dall'ambiente. Al contrario, in una reazione esotermica l'entalpia dei reagenti è maggiore di quella dei prodotti, poiché la reazione cede calore all'ambiente.
Entalpia standard
Poiché la variazione di entalpia in una reazione chimica può dipendere dalla pressione e dalla temperatura, è consuetudine definire condizioni di reazione standard:
Temperatura di reazione standard: 25 ° C.
Pressione di reazione standard: 1 atm = 1 bar.
L'entalpia standard è indicata in questo modo: H °
Termochimica
In un'equazione termochimica, non solo i reagenti ei prodotti contano, ma anche la variazione dell'entalpia. Per entalpia si intende la reazione al cambiamento avvenuto durante lo stesso.
Ad esempio, diamo un'occhiata alle seguenti reazioni:
2 H2 (gas) + O2 (gas) → 2 H2O (liquido); ΔH ° = -571,6 kJ (esotermico).
H2 (gas) + (½) O2 (gas) → H2O (liquido); ΔH ° = -285,8 kJ (esotermico).
2 H2O (liquido) → 2 H2 (gas) + O2 (gas); ΔH ° = +571,6 kJ (endotermico).
L'entalpia è una grande quantità termodinamica
Se i termini di un'equazione chimica vengono moltiplicati o divisi per un determinato fattore, l'entalpia viene moltiplicata o divisa per lo stesso.
Se la reazione è invertita, anche il segno dell'entalpia di reazione viene invertito.
Esercizi risolti
-Esercizio 1
Il gas acetilene C2H2 è ottenuto dalla reazione del carburo di calcio CaC2 che si presenta in forma granulata con acqua a temperatura e pressione ambiente..
Come dati abbiamo le entalpie di formazione dei reagenti:
ΔH ° (CaC2) = -59,0 kJ / mol
ΔH ° (H20) = -285,8 kJ / mol
E l'entalpia di formazione dei prodotti:
ΔH ° (C2H2) = +227,0 kJ / mol
ΔH ° (Ca (OH) 2) = -986,0 kJ / mol
Trova l'entropia standard della reazione.
Soluzione
La prima cosa è proporre l'equazione chimica bilanciata:
CaC2 (s) + 2H20 (l) → Ca (OH) 2 (s) + C2H2 (g)
E ora le entalpie dei reagenti, dei prodotti e della reazione:
- Reagenti: -59,0 kJ / mol -2 ∙ 285,8 kJ / mol = -630,6 kJ / mol
- Prodotti: -986,0 kJ / mol + 227,0 kJ / mol = -759 kJ / mol
- Reazione: ΔH ° = -759 kJ / mol - (-630 kJ / mol) = -129 kJ / mol
È una reazione esotermica.
-Esercizio 2
Quando 1 litro di acetilene viene bruciato in condizioni standard, quanto calore viene emesso?
Soluzione
Una volta bilanciata, la reazione di combustione dell'acetilene si presenta così:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (l)
Abbiamo bisogno delle entalpie di formazione dei prodotti:
ΔH ° (CO2) = -393,5 kJ / mol
ΔH ° (H2O (l)) = -285,8 kJ / mol
Calcolo delle entalpie
Con questi dati possiamo calcolare l'entalpia dei prodotti:
ΔH ° (prodotti) = 2 * (- 393,5 kJ / mol) + (-285,8 kJ / mol) = -1072,8 kJ / mol
E l'entalpia di formazione dei reagenti:
ΔH ° (C2H2) = 227,0 kJ / mol
ΔH ° (O2) = 0,0 kJ / mol
L'entalpia dei reagenti sarà:
227,0 kJ / mol + (5/2) * 0,0 = 227,0 kJ / mol
L'entalpia molare della reazione sarà quindi: ΔH ° (prodotti) - ΔH ° (reagenti) = -1072,8 kJ / mol - 227,0 kJ / mol = -1299,8 kJ / mol
Entalpia di combustione
Ora dobbiamo sapere quante moli di acetilene sono un litro di acetilene in condizioni standard. Per questo useremo l'equazione di stato di un gas ideale, da cui risolveremo il numero di moli.
Numero di moli n = P * V / (R * T)
P = 1 atm = 1.013 x 10⁵ Pa
V = 1 l = 1,0 x 10 ^ -3 m³
R = 8,31 J / (mol * K)
T = 25 ° C = 298,15 K
n = 0,041 mol
L'entalpia di combustione di 1 litro di acetilene è 0,041 mol * (-1299,8 kJ / mol) = -53,13 kJ
Il segno negativo indica che si tratta di una reazione esotermica che sprigiona 53,13 kJ = 12,69 kcal.
Riferimenti
- Castagne E. Entalpia nelle reazioni chimiche. Estratto da: lidiaconlaquimica.wordpress.com
- Termochimica. Entalpia di reazione. Estratto da: recursostic.educacion.es
- Termochimica. Definizione di entalpia di reazione standard. Estratto da: quimitube.com
- Wikipedia. Entalpia di reazione standard. Estratto da: wikipedia.com
- Wikipedia. Entalpia di formazione. Estratto da: wikipedia.com


Nessun utente ha ancora commentato questo articolo.