
Caratteristiche e tipologie del legame estere

UN legame estere è definito come il legame tra un gruppo alcolico (-OH) e un gruppo acido carbossilico (-COOH), formato dall'eliminazione di una molecola d'acqua (HDueO) (Futura-Sciences ,, S.F.).
La struttura dell'acetato di etile è mostrata nella Figura 1. Il legame estere è quel legame unico che si forma tra l'ossigeno dell'acido carbossilico e il carbonio dell'etanolo.

R-COOH + R'-OH → R-COO-R '+ HDueO
Nella figura, la parte blu corrisponde alla parte del composto che proviene dall'etanolo e la parte gialla corrisponde all'acido acetico. Il legame estere è segnato nel cerchio rosso.
Indice articolo
- 1 Idrolisi del legame estere
- 2 tipi di esteri
- 2.1 Estere carbonico
- 2.2 Estere fosforico
- 2.3 Estere solforico
- 3 Riferimenti
Idrolisi del legame estere
Per comprendere un po 'meglio la natura dei legami estere, viene spiegato il meccanismo di reazione dell'idrolisi di questi composti. Il legame estere è relativamente debole. In mezzo acido o basico si idrolizza per formare rispettivamente alcol e acido carbossilico. Il meccanismo di reazione dell'idrolisi degli esteri è ben studiato.
Nel mezzo di base, gli idrossidi nucleofili attaccano per primo il C elettrofilo dell'estere C = O, rompendo il legame π e creando l'intermedio tetraedrico.
L'intermedio quindi collassa, riformando il C = O, con conseguente perdita del gruppo uscente, l'alcossido, RO-, che porta all'acido carbossilico..
Infine, una reazione acido / base è un equilibrio molto veloce dove l'alcossido, RO- funziona come una base che deprotona l'acido carbossilico, RCO2H, (un trattamento acido permetterebbe di ottenere l'acido carbossilico dalla reazione).

Il meccanismo di idrolisi del legame estereo in un mezzo acido è un po 'più complicato. Prima si verifica una reazione acido / base, poiché hai solo un nucleofilo debole e un elettrofilo scarso è necessario attivare l'estere.
La protonazione dell'estere carbonilico lo rende più elettrofilo. Nella seconda fase, l'ossigeno nell'acqua funge da nucleofilo attaccando l'elettrofilo C nel C = O, con gli elettroni che si muovono verso lo ione idronio, creando l'intermedio tetraedrico..
Nella terza fase, si verifica una reazione acido / base, deprotando l'ossigeno proveniente dalla molecola d'acqua per neutralizzare la carica..
Nella quarta fase, si verifica un'altra reazione acido / base. Devi estrarre -OCH3, ma devi renderlo un buon gruppo in partenza per protonazione.
Nella quinta fase, usano gli elettroni di un ossigeno adiacente per aiutare a "spingere fuori" il gruppo uscente, producendo una molecola di alcol neutra..
Nell'ultimo passaggio si verifica una reazione acido / base. La deprotonazione dello ione idronio rivela il carbonile C = O nel prodotto di acido carbossilico e rigenera il catalizzatore acido (Dr.Ian Hunt, S.F.).
Tipi di esteri
Estere carbonico
Gli esteri carbonici sono i più comuni di questo tipo di composto. Il primo estere carbonico era l'acetato di etile o anche chiamato etanoato di etile. In precedenza questo composto era noto come aceto etere, il cui nome in tedesco è Essig-Äther la cui contrazione era derivata dal nome di questo tipo di composto.
Gli esteri si trovano in natura e sono ampiamente utilizzati nell'industria. Molti esteri hanno odori di frutta caratteristici e molti sono naturalmente presenti negli oli essenziali delle piante. Ciò ha anche portato al suo uso comune nei profumi e nelle fragranze artificiali quando gli odori cercano di essere imitati..
Ogni anno vengono prodotti industrialmente diversi miliardi di chilogrammi di poliesteri, prodotti importanti così come sono; polietilentereftalato, esteri di acrilato e acetato di cellulosa.
Il legame estere degli esteri carbossilici è responsabile della formazione dei trigliceridi negli organismi viventi.
I trigliceridi si trovano in tutte le cellule, ma principalmente nel tessuto adiposo, sono la principale riserva energetica di cui dispone l'organismo. I triacilgliceridi (TAG) sono molecole di glicerolo legate a tre acidi grassi tramite un legame estere. Gli acidi grassi presenti nei TAG sono prevalentemente saturi (Wilkosz, 2013).
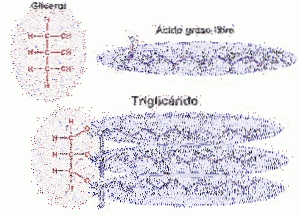
I triacilgliceridi (trigliceridi) sono sintetizzati praticamente in tutte le cellule. I principali tessuti per la sintesi di TAG sono l'intestino tenue, il fegato e gli adipociti. Ad eccezione dell'intestino e degli adipociti, la sintesi dei TAG inizia con il glicerolo.
Il glicerolo viene prima fosforilato con glicerolo chinasi e quindi gli acidi grassi attivati (acil-CoA grassi) fungono da substrati per l'aggiunta di acidi grassi generatori di acido fosfatidico. Il gruppo fosfato viene rimosso e viene aggiunto l'ultimo acido grasso.
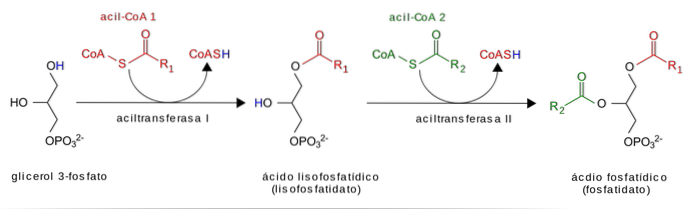
Nell'intestino tenue, i TAG alimentari vengono idrolizzati per rilasciare acidi grassi e monoacilgliceridi (MAG) prima dell'assorbimento da parte degli enterociti. I MAG degli enterociti fungono da substrati per l'acilazione in un processo in due fasi che produce un TAG.
All'interno del tessuto adiposo non c'è espressione di glicerolo chinasi, quindi l'elemento costitutivo del TAG in questo tessuto è l'intermedio glicolitico, il diidrossiacetone fosfato, DHAP.
Il DHAP viene ridotto a glicerolo-3-fosfato dalla glicerolo-3-fosfato deidrogenasi citosolico e la restante reazione di sintesi del TAG è la stessa di tutti gli altri tessuti.
Estere fosforico
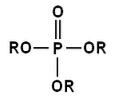
Gli esteri fosforici sono prodotti dalla formazione di un legame estere tra un alcol e l'acido fosforico. Data la struttura dell'acido, questi esteri possono essere mono, di e trisostituiti.
Questi tipi di legami estere si trovano in composti come fosfolipidi, ATP, DNA e RNA..
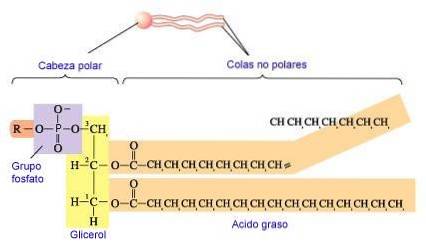
I fosfolipidi sono sintetizzati dalla formazione di un legame estere tra un alcol e il fosfato di acido fosfatidico (1,2-diacilglicerolo 3-fosfato). La maggior parte dei fosfolipidi ha un acido grasso saturo su C-1 e un acido grasso insaturo su C-2 della spina dorsale del glicerolo.
Gli alcoli più comunemente aggiunti (serina, etanolamina e colina) contengono anche azoto che può essere caricato positivamente, mentre glicerolo e inositolo no (King, 2017).
L'adenosina trifosfato (ATP) è una molecola utilizzata come valuta energetica nella cellula. Questa molecola è composta da una molecola di adenina legata alla molecola di ribosio con tre gruppi fosfato (figura 8).
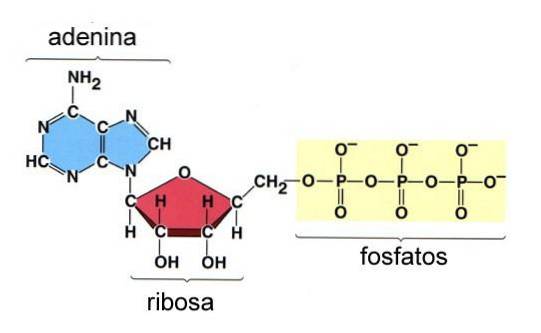
I tre gruppi fosfato della molecola sono chiamati gamma (γ), beta (β) e Alpha (α), quest'ultimo esterificando il gruppo idrossile C-5 del ribosio.
Il legame tra ribosio e il gruppo α-fosforile è un legame fosfoestere perché include un atomo di carbonio e un atomo di fosforo, mentre i gruppi β- e γ-fosforile in ATP sono collegati da legami fosfoanidridici che non coinvolgono atomi di carbonio..
Tutti i fosfoanidro hanno una considerevole energia potenziale chimica e l'ATP non fa eccezione. Questa energia potenziale può essere utilizzata direttamente nelle reazioni biochimiche (ATP, 2011).
Un legame fosfodiestere è un legame covalente in cui un gruppo fosfato è attaccato ai carboni adiacenti tramite legami estere. Il legame è il risultato di una reazione di condensazione tra un gruppo idrossile di due gruppi di zucchero e un gruppo fosfato.
Il legame diestere tra l'acido fosforico e due molecole di zucchero nel DNA e l'RNA della spina dorsale collega due nucleotidi insieme per formare polimeri oligonucleotidici. Il legame fosfodiestere collega un carbonio 3 'a un carbonio 5' nel DNA e nell'RNA.
(base1) - (ribosio) -OH + HO-P (O) 2-O- (ribosio) - (base 2)
(base1) - (ribosio) - O - P (O) 2 - O- (ribosio) - (base 2) + HDueO
Durante la reazione di due dei gruppi idrossilici nell'acido fosforico con un gruppo idrossile in altre due molecole, si formano due legami estere in un gruppo fosfodiestere. Una reazione di condensazione in cui si perde una molecola d'acqua genera ciascun legame estere.
Durante la polimerizzazione dei nucleotidi per formare acidi nucleici, il gruppo idrossile del gruppo fosfato si lega al carbonio 3 'di uno zucchero di un nucleotide per formare un legame estere al fosfato di un altro nucleotide.
La reazione forma un legame fosfodiestere e rimuove una molecola d'acqua (formazione di legame fosfodiestere, S.F.).
Estere solforico
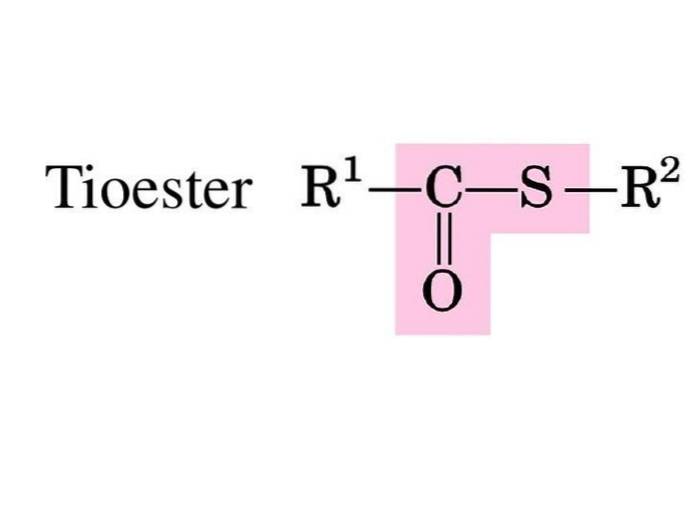
Gli esteri solforici o tioesteri sono composti con il gruppo funzionale R-S-CO-R '. Sono il prodotto dell'esterificazione tra un acido carbossilico e un tiolo o con acido solforico (Block, 2016).
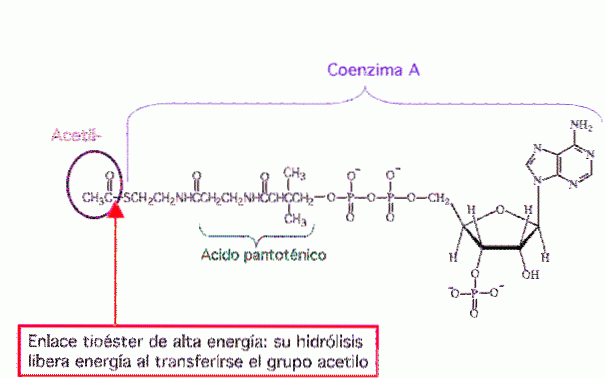
In biochimica, i tioesteri più noti sono derivati del coenzima A, ad esempio, acetil-CoA.
L'acetil coenzima A o acetil-CoA (Figura 8) è una molecola che partecipa a molte reazioni biochimiche. È una molecola centrale nel metabolismo di lipidi, proteine e carboidrati.
La sua funzione principale è quella di fornire il gruppo acetile al ciclo dell'acido citrico (ciclo di Krebs) da ossidare per la produzione di energia. È anche la molecola precursore della sintesi degli acidi grassi ed è un prodotto della degradazione di alcuni amminoacidi.
Gli acidi grassi attivati dal CoA sopra menzionati sono altri esempi di tioesteri originari della cellula muscolare. L'ossidazione dei tioesteri degli acidi grassi-CoA si verifica in realtà in corpi vescicolari discreti chiamati mitocondri (Thompson, 2015).
Riferimenti
- ATP. (2011, 10 agosto). Recupero da learnbiochemistry.wordpress: learnbiochemistry.wordpress.com.
- Block, E. (2016, 22 aprile). Composto di organosulfur. Estratto da britannica: britannica.com.
- Ian Hunt. (S.F.). Idrolisi degli esteri. Recupero da chem.ucalgary.ca: chem.ucalgary.ca.
- Futura-Sciences,. (S.F.). Legame estere. Recupero da futura-sciences.us.
- King, M. W. (2017, 16 marzo). Sintesi e metabolismo di acidi grassi, trigliceridi e fosfolipidi. Estratto da themedicalbiochemistrypage.org.
- formazione di legami fosfodiesteri. (S.F.). Recupero da biosyn: biosyn.com.
- Thompson, T. E. (2015, 19 agosto). Lipidi. Recupero da britannica: britannica.com.
- Wilkosz, R. (2013, 6 novembre). La formazione di legami estere nella sintesi dei lipidi. Recuperato da wisc-online.com.



Nessun utente ha ancora commentato questo articolo.