
Sigma Link Com'è formato, caratteristiche ed esempi
Il sigma link (rappresentato come σ) è un'unione di tipo covalente, che è caratterizzata dalla condivisione di due elettroni che si verifica tra una coppia di atomi per formare detto legame. Inoltre, questo è un tipo di legame singolo, in cui entrambi gli atomi sono attaccati da due elettroni per formare un unico legame..
Quando due o più atomi si combinano per dare origine a nuovi composti molecolari, vengono uniti per mezzo di due tipi di legami: ionico e covalente, la cui struttura dipende da come gli elettroni sono condivisi tra i due atomi coinvolti in questo accoppiamento..
La connessione generata tramite gli elettroni avviene grazie alla sovrapposizione degli orbitali che appartengono a ciascun atomo (per le loro estremità), intendo come orbitali gli spazi dove è più probabile che si trovi l'elettrone nell'atomo e che sono definiti dall'elettrone densità.
Indice articolo
- 1 Come si forma?
- 1.1 Formazione di legami sigma in diverse specie chimiche
- 2 caratteristiche
- 3 esempi
- 4 Riferimenti
Come si forma?
Tipicamente, il singolo legame tra due atomi è noto per essere equivalente a un singolo legame sigma..
Allo stesso modo, questi legami hanno origine a causa della sovrapposizione o sovrapposizione in modo frontale che si verifica tra le estremità degli orbitali atomici di due diversi atomi..
Questi atomi i cui orbitali si sovrappongono devono essere adiacenti l'uno all'altro in modo che i singoli elettroni appartenenti a ciascun orbitale atomico possano legarsi efficacemente e formare il legame..
Da qui il fatto che la distribuzione elettronica che si manifesta o la posizione della densità degli elettroni da ciascuna sovrapposizione ha una simmetria cilindrica attorno all'asse che si verifica tra le due specie atomiche collegate..
In questo caso, il cosiddetto orbitale sigma può essere più facilmente espresso in termini di legami intramolecolari che si formano all'interno di molecole biatomiche, notando che esistono anche diversi tipi di legami sigma..
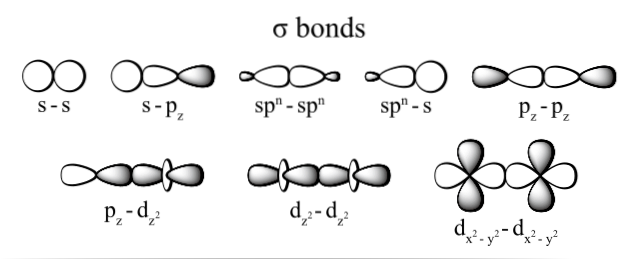
I tipi di legame sigma più comunemente osservati sono: dzDue+dzDue, s + pz, pz+pz e s + s; dove il pedice z rappresenta l'asse costituito dal legame formato e ogni lettera (s, pe d) corrisponde ad un orbitale.
Formazione di legami sigma in diverse specie chimiche
Quando si parla di orbitali molecolari si fa riferimento alle regioni che accumulano la più alta densità di elettroni quando si forma un legame di questo tipo tra molecole diverse, ottenute attraverso la combinazione di orbitali atomici..
Dal punto di vista della meccanica quantistica, gli studi hanno dedotto che gli orbitali di tipo molecolare che mostrano un comportamento simmetricamente uguale sono effettivamente combinati in miscele (ibridazioni).
Tuttavia, il significato di questa combinazione di orbitali è strettamente correlato alle energie relative manifestate da orbitali di tipo molecolare che sono simmetricamente simili..
Nel caso di molecole organiche, si osservano frequentemente specie cicliche costituite da una o più strutture ad anello, che sono spesso costituite da un gran numero di legami di tipo sigma in congiunzione con legami di tipo pi (legami multipli)..
Infatti, utilizzando semplici calcoli matematici, è possibile determinare il numero di legami sigma presenti in una specie molecolare..
Esistono anche casi di composti di coordinazione (con metalli di transizione), in cui più legami sono combinati con diverse classi di interazioni di legame, così come molecole composte da diversi tipi di atomi (poliatomici).
Caratteristiche
I legami sigma hanno caratteristiche uniche che li differenziano nettamente da altri tipi di legame covalente (legame pi), tra cui il fatto che questo tipo di legame è il più forte tra i legami chimici della classe covalente.
Questo perché la sovrapposizione tra gli orbitali avviene direttamente, coassialmente (o linearmente) e frontalmente; cioè, si ottiene una sovrapposizione massima tra gli orbitali.
Inoltre, la distribuzione elettronica a queste giunzioni è concentrata principalmente tra i nuclei delle specie atomiche che vengono combinate..
Questa sovrapposizione di orbitali sigma avviene in tre modi possibili: tra una coppia di orbitali puri (s-s), tra un orbitale puro e un tipo ibrido (s-sp), o tra una coppia di orbitali di tipo ibrido (sp3- sp3).
L'ibridazione avviene grazie alla miscela di orbitali di origine atomica di classi differenti, ottenendo che l'orbitale ibrido risultante dipende dalla quantità di ciascuno dei tipi di orbitali di partenza puri (ad esempio sp3 = un orbitale s puro + tre orbitali di tipo p puro).
Oltre a questo, il legame sigma può esistere indipendentemente, così come ammette il libero movimento rotatorio tra una coppia di atomi..
Esempi
Poiché il legame covalente è il tipo più comune di legame tra gli atomi, il legame sigma si trova in un numero enorme di specie chimiche, come si può vedere di seguito.
Nelle molecole di gas biatomico, come l'idrogeno (H.Due), ossigeno (ODue) e azoto (NDue) - possono verificarsi diversi tipi di legame a seconda dell'ibridazione degli atomi.
Nel caso dell'idrogeno, c'è un singolo legame sigma che unisce entrambi gli atomi (H-H), perché ogni atomo contribuisce con il suo unico elettrone.
D'altra parte, nell'ossigeno molecolare entrambi gli atomi sono legati da un doppio legame (O = O), cioè un legame sigma e un legame pi, lasciando ogni atomo con tre coppie di elettroni rimanenti accoppiati.
Invece, ogni atomo di azoto ha cinque elettroni nel suo livello di energia più esterno (guscio di valenza), quindi sono uniti da un triplo legame (N≡N), che implica la presenza di un legame sigma e due legami pi e una coppia di elettroni accoppiati in ogni atomo.
Allo stesso modo, si verifica nei composti di tipo ciclico con legami singoli o multipli e in tutti i tipi di molecole la cui struttura è costituita da legami covalenti..
Riferimenti
- Wikipedia. (s.f.). Sigma bond. Estratto da en.wikipedia.org
- Chang, R. (2007). Chimica, nona edizione. Messico: McGraw-Hill.
- ThoughtCo. (s.f.). Definizione di chimica del legame di Sigma. Recuperato da thoughtco.com
- Britannica, E. (s.f.). Sigma bond. Estratto da britannica.com
- LibreTexts. (s.f.). Sigma e Pi obbligazioni. Recupero da chem.libretexts.org
- Srivastava, A. K. (2008). Chimica organica resa semplice. Recupero da books.google.co.ve



Nessun utente ha ancora commentato questo articolo.