
Caratteristiche ed esempi del legame covalente polare

UN legame covalente polare È quello formato tra due elementi chimici la cui differenza di elettronegatività è sostanziale, ma senza avvicinarsi a un carattere puramente ionico. Si tratta quindi di una forte interazione intermedia tra i legami covalenti apolari e i legami ionici..
Si dice che sia covalente perché in teoria c'è una condivisione uguale di una coppia elettronica tra i due atomi legati; cioè, i due elettroni sono condivisi equamente. L'atomo E dona un elettrone, mentre X contribuisce al secondo elettrone per formare il legame covalente E: X o E-X.
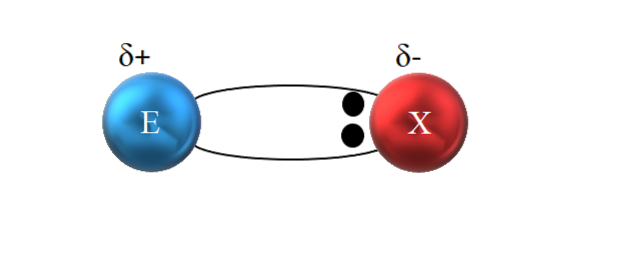
Tuttavia, come si vede nell'immagine sopra, i due elettroni non si trovano al centro di E e X, indicando che "circolano" con la stessa frequenza tra i due atomi; piuttosto sono più vicini a X che a E. Ciò significa che X ha attratto la coppia di elettroni verso se stesso a causa della sua maggiore elettronegatività.
Poiché gli elettroni del legame sono più vicini a X che a E, intorno a X si crea una regione di alta densità elettronica, δ-; mentre in E appare una regione povera di elettroni, δ +. Pertanto, c'è una polarizzazione delle cariche elettriche: un legame covalente polare.
Indice articolo
- 1 Caratteristiche
- 1.1 Gradi di polarità
- 1.2 Elementi chimici che li originano
- 1.3 Carattere polare e ionico
- 2 Esempi di legame covalente polare
- 2.1 C-O
- 2.2 H-X
- 2.3 O-H
- 2.4 N-H
- 2.5 Fe-O
- 3 Riferimenti
Caratteristiche
Gradi di polarità
I legami covalenti sono molto abbondanti in natura. Sono presenti praticamente in tutte le molecole e i composti chimici eterogenei; poiché, alla fine, si forma quando due diversi atomi E e X si legano. Tuttavia, ci sono legami covalenti più polari di altri e per scoprirlo bisogna ricorrere alle elettronegatività.
Più X è elettronegativo e meno E è elettronegativo (elettropositivo), il legame covalente risultante sarà più polare. Il modo convenzionale per stimare questa polarità è attraverso la formula:
χX - χE
Dove χ è l'elettronegatività di ogni atomo secondo la scala di Pauling.
Se questa sottrazione o sottrazione ha valori compresi tra 0,5 e 2, sarà un legame polare. Pertanto, è possibile confrontare il grado di polarità tra i vari collegamenti E-X. Nel caso in cui il valore ottenuto sia maggiore di 2 si parla di legame ionico, E+X- E non lo èδ+-Xδ-.
Tuttavia, la polarità del legame E-X non è assoluta, ma dipende dall'ambiente molecolare; cioè in una molecola -E-X-, dove E ed X formano legami covalenti con altri atomi, questi ultimi influenzano direttamente detto grado di polarità.
Elementi chimici che li originano
Sebbene E e X possano essere qualsiasi elemento, non tutti causano legami covalenti polari. Ad esempio, se E è un metallo altamente elettropositivo, come quelli alcalini (Li, Na, K, Rb e Cs), e X è un alogeno (F, Cl, Br e I), tenderanno a formare composti ionici (N / A+Cl-) e nessuna molecola (Na-Cl).
Questo è il motivo per cui i legami covalenti polari si trovano solitamente tra due elementi non metallici; e, in misura minore, tra elementi non metallici e alcuni metalli di transizione. Guardando il blocco p della tavola periodica, hai molte opzioni per formare questi tipi di legami chimici.
Carattere polare e ionico
Nelle grandi molecole non è molto importante pensare a quanto sia polare un legame; Questi sono altamente covalenti e la distribuzione delle loro cariche elettriche (dove sono le regioni ricche o povere di elettroni) attira più attenzione che definire il grado di covalenza dei loro legami interni..
Tuttavia, con molecole biatomiche o piccole, detta polarità Eδ+-Xδ- è abbastanza relativo.
Questo non è un problema con le molecole formate tra elementi non metallici; Ma quando partecipano metalli di transizione o metalloidi, non parliamo più solo di un legame covalente polare, ma di un legame covalente con un certo carattere ionico; e nel caso dei metalli di transizione, di un legame di coordinazione covalente data la sua natura.
Esempi di legame covalente polare
CO
Il legame covalente tra carbonio e ossigeno è polare, perché il primo è meno elettronegativo (χC = 2,55) rispetto al secondo (χO = 3,44). Pertanto, quando vediamo i legami C-O, C = O o C-O-, sapremo che sono legami polari.
H-X
Gli alogenuri di idrogeno, HX, sono esempi ideali per comprendere il legame polare nelle molecole biatomiche. Avendo l'elettronegatività dell'idrogeno (χH = 2.2), possiamo stimare quanto siano polari tra loro questi alogenuri:
-HF (H-F), χF (3.98) - χH (2,2) = 1,78
-HCl (H-Cl), χCl (3.16) - χH (2,2) = 0,96
-HBr (H-Br), χBr (2,96) - χH (2,2) = 0,76
-HI (H-I), χio (2,66) - χH (2,2) = 0,46
Si noti che secondo questi calcoli, il legame H-F è il più polare di tutti. Ora, qual è il suo carattere ionico espresso in percentuale, è un'altra questione. Questo risultato non è sorprendente perché il fluoro è l'elemento più elettronegativo di tutti..
Quando l'elettronegatività scende dal cloro allo iodio, anche i legami H-Cl, H-Br e H-I diventano meno polari. Il legame H-I dovrebbe essere apolare, ma in realtà è polare e anche molto "fragile"; si rompe facilmente.
OH
Il legame polare O-H è forse il più importante di tutti: grazie ad esso la vita esiste, poiché collabora con il momento di dipolo dell'acqua. Se stimiamo la differenza tra le elettronegatività dell'ossigeno e degli idrogeni avremo:
χO (3.44) - χH (2,2) = 1,24
Tuttavia, la molecola d'acqua, H.DueOppure hai due di questi legami, H-O-H. Questo, e la geometria angolare della molecola e la sua asimmetria, ne fanno un composto altamente polare..
N-H
Il legame N-H è presente nei gruppi amminici delle proteine. Ripetendo lo stesso calcolo abbiamo:
χN (3.04) - χH (2,2) = 0,84
Ciò riflette che il legame N-H è meno polare di O-H (1.24) e F-H (1.78).
Brutto
Il legame Fe-O è importante perché i suoi ossidi si trovano nei minerali di ferro. Vediamo se è più polare di H-O:
χO (3.44) - χFede (1,83) = 1,61
Quindi si presume giustamente che il legame Fe-O sia più polare del legame H-O (1.24); o che cosa equivale a dire: Fe-O ha un carattere ionico maggiore di H-O.
Questi calcoli vengono utilizzati per calcolare i gradi di polarità tra i vari collegamenti; ma non sono sufficienti per determinare se un composto è ionico, covalente o il suo carattere ionico.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Laura Nappi. (2019). Legami covalenti polari e non polari: definizioni ed esempi. Studia. Estratto da: study.com
- Helmenstine, Anne Marie, Ph.D. (18 settembre 2019). Definizione ed esempi di legame polare (legame covalente polare). Estratto da: thoughtco.com
- Elsevier B.V. (2019). Legame covalente polare. ScienceDirect. Estratto da: sciencedirect.com
- Wikipedia. (2019). Polarità chimica. Estratto da: en.wikipedia.org
- Anonimo. (05 giugno 2019). Proprietà dei legami covalenti polari. Chemistry LibreTexts. Recupero da: chem.libretexts.org


Nessun utente ha ancora commentato questo articolo.