
Energia di attivazione chimica In cosa consiste, Calcolo

Il energia di attivazione chimica (dal punto di vista degli studi cinetici) si riferisce alla minor quantità possibile di energia necessaria per avviare una reazione chimica. Secondo la teoria delle collisioni nella cinetica chimica, si dice che tutte le molecole in movimento abbiano una certa quantità di energia cinetica.
Ciò significa che maggiore è la velocità del suo movimento, maggiore è l'entità della sua energia cinetica. In questo senso, una molecola che trasporta un movimento veloce non può essere divisa in frammenti da sola, quindi deve verificarsi una collisione tra essa e un'altra molecola affinché abbia luogo una reazione chimica..
Quando ciò accade - quando c'è una collisione tra le molecole - una frazione della loro energia cinetica si trasforma in energia vibrazionale. Allo stesso modo, se all'inizio del processo l'energia cinetica è elevata, le molecole che partecipano alla collisione presenteranno una vibrazione così grande che alcuni dei legami chimici presenti si spezzeranno..
Questa rottura dei legami costituisce il primo passo nella trasformazione dei reagenti in prodotti; vale a dire nella formazione di questi. Al contrario, se all'inizio di questo processo l'energia cinetica è di piccola entità, si verificherà un fenomeno di "rimbalzo" delle molecole, attraverso il quale verranno separate praticamente intatte..
Indice articolo
- 1 Cosa fa?
- 1.1 Complesso attivato
- 2 Come viene calcolato?
- 2.1 Calcolo dell'energia di attivazione di una reazione chimica
- 3 In che modo l'energia di attivazione influisce sulla velocità di una reazione?
- 4 Esempi di calcolo dell'energia di attivazione
- 5 Riferimenti
In cosa consiste?
Partendo dal concetto di collisioni tra molecole per avviare reazioni chimiche precedentemente descritte, si può affermare che è necessaria una quantità minima di energia perché si verifichi una collisione..
Quindi, se il valore di energia è inferiore a questo minimo necessario, semplicemente non ci sarà alcuna alterazione tra le molecole dopo che si è verificata la collisione, il che significa che quando questa energia è assente, le specie coinvolte rimangono praticamente intatte e non avverrà. Nessun cambiamento a causa di questo incidente.
In questo ordine di idee, l'energia minima necessaria affinché si verifichi un cambiamento dopo una collisione tra molecole è chiamata energia di attivazione..
In altre parole, le molecole coinvolte in una collisione devono possedere una quantità totale di energia cinetica uguale o superiore all'energia di attivazione affinché si verifichi una reazione chimica..
Allo stesso modo, in molti casi le molecole si scontrano e danno origine a una nuova specie chiamata complesso attivato, una struttura che è anche chiamata "stato di transizione" perché esiste solo temporaneamente..
È causato dalle specie reagenti a causa della collisione e prima della formazione dei prodotti di reazione.
Complesso attivato
Il complesso attivato sopra menzionato forma una specie che ha una stabilità molto bassa ma, a sua volta, ha una grande grandezza di energia potenziale..
Il diagramma seguente mostra la trasformazione dei reagenti in prodotti, espressa in termini di energia e rilevando che l'entità dell'energia del complesso attivato che si forma è notevolmente maggiore di quella dei reagenti e dei prodotti..
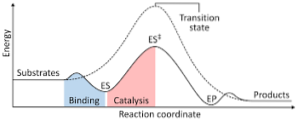
Se al termine della reazione i prodotti hanno una stabilità maggiore rispetto alle sostanze reagenti, il rilascio di energia avviene sotto forma di calore, dando una reazione esotermica..
Al contrario, se i reagenti determinano una stabilità maggiore rispetto ai prodotti, significa che la miscela di reazione manifesta un assorbimento di energia sotto forma di calore dall'ambiente circostante, determinando una reazione endotermica..
Allo stesso modo, se si verifica un caso o l'altro, dovrebbe essere costruito un diagramma come quello mostrato in precedenza, dove viene tracciata l'energia potenziale del sistema che reagisce contro l'avanzamento o l'andamento della reazione..
Pertanto, si ottengono i potenziali cambiamenti di energia che si verificano mentre la reazione procede e i reagenti vengono trasformati in prodotti..
Come viene calcolato?
L'energia di attivazione di una reazione chimica è strettamente correlata alla costante di velocità di detta reazione, e la dipendenza di questa costante rispetto alla temperatura è rappresentata dall'equazione di Arrhenius:
k = Ae-Ea / RT
In questa espressione K rappresenta la costante di velocità della reazione (che dipende dalla temperatura) e il parametro PER è chiamato fattore di frequenza ed è una misura della frequenza delle collisioni tra le molecole.
Da parte sua, e esprime la base della serie dei logaritmi naturali. Viene elevato ad una potenza pari al quoziente negativo dell'energia di attivazione (Ea) tra il prodotto risultante dalla costante del gas (R) e la temperatura assoluta (T) del sistema da considerare.
Va notato che il fattore di frequenza può essere considerato come una costante in alcuni sistemi di reazione su un ampio intervallo di temperature..
Questa espressione matematica fu originariamente supposta dal chimico olandese Jacobus Henricus van't Hoff nel 1884, ma colui che le diede validità scientifica e ne interpretò la premessa fu il chimico svedese Svante Arrhenius, nel 1889.
Calcolo dell'energia di attivazione di una reazione chimica
L'equazione di Arrhenius specifica la proporzionalità diretta che esiste tra la costante di velocità di una reazione e la frequenza delle collisioni tra le molecole.
Allo stesso modo, questa equazione può essere rappresentata in modo più conveniente applicando la proprietà dei logaritmi naturali a ciascun lato dell'equazione, ottenendo:
ln k = ln A - Ea / RT
Riorganizzando i termini in termini di ottenere l'equazione di una retta (y = mx + b), si ottiene la seguente espressione:
ln k = (- Ea / R) (1 / T) + ln A
Quindi, quando si costruisce un grafico di ln k contro 1 / T, si ottiene una linea retta, dove ln k rappresenta la coordinata e, (-Ea / R) rappresenta la pendenza della linea (m), (1 / T) rappresenta la coordinata x, e ln A rappresenta l'intercetta con l'asse delle ordinate (b).
Come si può vedere, la pendenza risultante da questo calcolo è pari al valore di -Ea / R. Ciò implica che, se si vuole ottenere il valore dell'energia di attivazione mediante questa espressione, è necessario effettuare una semplice chiarificazione di questo, risultando in:
Ea = -mR
Qui il valore di m è noto e R è una costante pari a 8.314 J / K mol.
In che modo l'energia di attivazione influisce sulla velocità di una reazione??
Quando si cerca di ottenere un'immagine dell'energia di attivazione, può essere considerata come una barriera che non consente il verificarsi di una reazione tra le molecole di energia inferiore..
Come in una reazione comune accade che il numero di molecole che possono reagire sia abbastanza grande, la velocità - ed equivalentemente l'energia cinetica di queste molecole - può essere molto variabile.
In genere accade che solo una piccola quantità della totalità delle molecole che subiscono una collisione - quelle che hanno una maggiore velocità di movimento - abbiano energia cinetica sufficiente per poter superare l'ampiezza dell'energia di attivazione. Quindi queste molecole sono adatte e in grado di far parte della reazione.
Secondo l'equazione di Arrhenius, il segno negativo -che precede il quoziente tra l'energia di attivazione e il prodotto della costante del gas e la temperatura assoluta- implica che la costante di velocità diminuisce all'aumentare dell'energia di attivazione, così come un crescita quando la temperatura aumenta.
Esempi di calcolo dell'energia di attivazione
Per calcolare l'energia di attivazione costruendo un grafico, secondo l'equazione di Arrhenius, le costanti di velocità per la reazione di decomposizione dell'acetaldeide sono state misurate a cinque diverse temperature e si desidera determinare l'energia di attivazione per la reazione, che è espressa come:
CH3CHO (g) → CH4(g) + CO (g)
I dati per le cinque misurazioni sono i seguenti:
k (1 / M1/2S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700-730-760-790-810
In primo luogo, per risolvere questo incognito e determinare l'energia di attivazione, è necessario costruire un grafico di ln k vs 1 / T (y vs x), per ottenere una linea retta e da qui prendere la pendenza e trovare il valore di Ea , come spiegato.
Trasformando i dati di misura, secondo l'equazione di Arrhenius [ln k = (- Ea / R) (1 / T) + ln A], si trovano rispettivamente i seguenti valori per y e x:
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-1): 1,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Da questi valori e mediante il calcolo matematico della pendenza - sia in un computer che in una calcolatrice, mediante l'espressione m = (YDue-Y1) / (XDue-X1) o utilizzando il metodo di regressione lineare si ottiene che m = -Ea / R = -2,09 * 104 K. Quindi:
Ea = (8,314 J / K mol) (2,09 * 104 K)
= 1,74 * 105 = 1,74 * 10Due kJ / mol
Per determinare altre energie di attivazione attraverso il modo grafico, viene eseguita una procedura simile.
Riferimenti
- Wikipedia. (s.f.). Energia di attivazione. Estratto da en.wikipedia.org
- Chang, R. (2007). Chimica, nona edizione. Messico: McGraw-Hill.
- Britannica, E. (s.f.). Energia di attivazione. Estratto da britannica.com
- Moore, J. W. e Pearson, R. G. (1961). Cinetica e meccanismo. Recupero da books.google.co.ve
- Kaesche, H. (2003). Corrosione dei metalli: principi fisico-chimici e problemi attuali. Ottenuto da books.google.co.ve


Nessun utente ha ancora commentato questo articolo.