
Proprietà, caratteristiche e usi del cromo

Il cromo (Cr) è un elemento metallico del gruppo 6 (VIB) della tavola periodica. Tonnellate di questo metallo vengono prodotte ogni anno attraverso la sua estrazione dal minerale cromite ferro o magnesio (FeCrDueO4, MgCrDueO4), che vengono ridotti con il carbonio per ottenere il metallo. È molto reattivo e solo in condizioni molto riducenti si trova nella sua forma pura.
Il suo nome deriva dalla parola greca "chroma", che significa colore. È stato dato questo nome a causa dei molteplici e intensi colori esibiti dai composti del cromo, sia inorganici che organici; da solidi o soluzioni neri a giallo, arancione, verde, viola, blu e rosso.

Tuttavia, il colore del cromo metallico e dei suoi carburi sono grigiastri argentei. Questa caratteristica è sfruttata nella tecnica della cromatura per donare scintillii argentati a molte strutture (come quelle viste nel coccodrillo nell'immagine sopra). Così, "bagnando con il cromo", i pezzi ricevono lucentezza e una grande resistenza alla corrosione..
Il cromo in soluzione reagisce rapidamente con l'ossigeno nell'aria per formare ossidi. A seconda del pH e delle condizioni ossidative del mezzo, può acquisire diversi numeri di ossidazione, essendo (III) (Cr3+) il più stabile di tutti. Di conseguenza, l'ossido di cromo (III) (CrDueO3) di colore verde è il più stabile dei suoi ossidi.
Questi ossidi possono interagire con altri metalli presenti nell'ambiente, provocando, ad esempio, il pigmento di piombo rosso siberiano (PbCrO4). Questo pigmento è giallo-arancio o rosso (secondo la sua alcalinità), e da esso lo scienziato francese Louis Nicolas Vauquelin ha isolato il rame metallico, motivo per cui viene premiato come suo scopritore.
I suoi minerali e ossidi, oltre a una minuscola porzione di rame metallico, fanno sì che questo elemento occupi il numero 22 dei più abbondanti nella crosta terrestre..
La chimica del cromo è molto varia perché può formare legami con quasi l'intera tavola periodica. Ciascuno dei suoi composti mostra colori che dipendono dal numero di ossidazione, nonché dalle specie che interagiscono con esso. Allo stesso modo, forma legami con il carbonio, intervenendo in un gran numero di composti organometallici..
[TOC]
Caratteristiche e proprietà
Il cromo è un metallo argenteo nella sua forma pura, con un numero atomico di 24 e un peso molecolare di circa 52 g / mol (52Cr, il suo isotopo più stabile).
Dati i suoi forti legami metallici, ha punti di fusione elevati (1907 ºC) e punti di ebollizione (2671 ºC). Inoltre, la sua struttura cristallina lo rende un metallo molto denso (7,19 g / mL).
Non reagisce con l'acqua per formare idrossidi, ma reagisce con gli acidi. Si ossida con l'ossigeno nell'aria, producendo generalmente ossido cromico, che è un pigmento verde ampiamente utilizzato..
Questi strati di ossido creano ciò che è noto come passivazione, proteggere il metallo dalla successiva corrosione, poiché l'ossigeno non può penetrare nel seno metallico.
La sua configurazione elettronica è [Ar] 4s13d5, con tutti gli elettroni spaiati, e quindi mostra proprietà paramagnetiche. Tuttavia, l'accoppiamento di spin elettronici può verificarsi se il metallo è sottoposto a basse temperature, acquisendo altre proprietà come l'antiferromagnetismo.
Indice articolo
- 1 Caratteristiche e proprietà
- 2 Struttura chimica del cromo
- 3 numero di ossidazione
- 3,1 Cr (-2, -1 e 0)
- 3.2 Cr (I) e Cr (II)
- 3,3 Cr (III)
- 3.4 Cr (IV) e Cr (V)
- 3.5 Cr (VI): la coppia cromato-bicromato
- 4 Usi di cromo
- 4.1 Come colorante o pigmenti
- 4.2 Nella cromatura o metallurgia
- 4.3 Nutrizionale
- 5 Dov'è?
- 6 Riferimenti
Struttura chimica del cromo
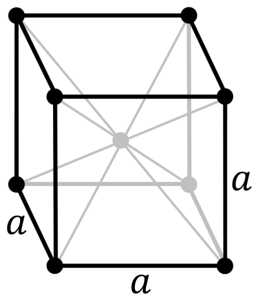
Qual è la struttura del metallo cromato? Nella sua forma pura, il cromo assume una struttura cristallina cubica centrata sul corpo (cc o bcc). Ciò significa che l'atomo di cromo si trova al centro di un cubo, i cui bordi sono occupati da altri cromi (come nell'immagine sopra).
Questa struttura è responsabile del cromo che ha alti punti di fusione e di ebollizione, nonché una grande durezza. Gli atomi di rame si sovrappongono ai loro orbitali se d per formare bande di conduzione secondo la teoria delle bande.
Pertanto, entrambe le bande sono piene a metà. Perché? Perché la sua configurazione elettronica è [Ar] 4s13d5 e poiché l'orbitale s può ospitare due elettroni e gli orbitali d dieci. Quindi, solo la metà delle bande formate dalle loro sovrapposizioni sono occupate da elettroni..
Con queste due prospettive - la struttura cristallina e il legame metallico - molte delle proprietà fisiche di questo metallo possono essere spiegate in teoria. Tuttavia, nessuno dei due spiega perché il cromo può avere vari stati o numeri di ossidazione..
Ciò richiederebbe una profonda comprensione della stabilità dell'atomo rispetto agli spin elettronici..
Numero di ossidazione
Perché la configurazione elettronica del cromo è [Ar] 4s13d5 può guadagnare fino a uno o due elettroni (Cr1- e CRDue-), o perderli per acquisire diversi numeri di ossidazione.
Quindi, se il cromo perde un elettrone, rimarrebbe come [Ar] 4s03d5; se perde tre, [Ar] 4s03d3; e se li perde tutti, [Ar], o ciò che è uguale, sarebbe isoelettronico all'argon.
Il cromo non perde o guadagna elettroni per puro capriccio: deve esserci una specie che li dona o li accetta per passare da un numero di ossidazione all'altro.
Il cromo ha i seguenti numeri di ossidazione: -2, -1, 0, +1, +2, +3, +4, +5 e +6. Di loro +3, Cr3+, è il più stabile e quindi predominante di tutti; seguito da +6, Cr6+.
Cr (-2, -1 e 0)
È altamente improbabile che il cromo guadagni elettroni, poiché è un metallo, e quindi la sua natura è donarli. Tuttavia, può coordinarsi con i ligandi, cioè le molecole che interagiscono con il centro del metallo attraverso un legame dativo..
Uno dei più noti è il monossido di carbonio (CO), che forma il composto esacarbonilico del cromo.
Questo composto ha la formula molecolare Cr (CO)6, e poiché i ligandi sono neutri e non forniscono alcuna carica, allora Cr ha un numero di ossidazione pari a 0.
Questo può essere osservato anche in altri composti organometallici come il bis (benzene) cromo. In quest'ultimo, il cromo è circondato da due anelli benzenici in una struttura molecolare di tipo sandwich:
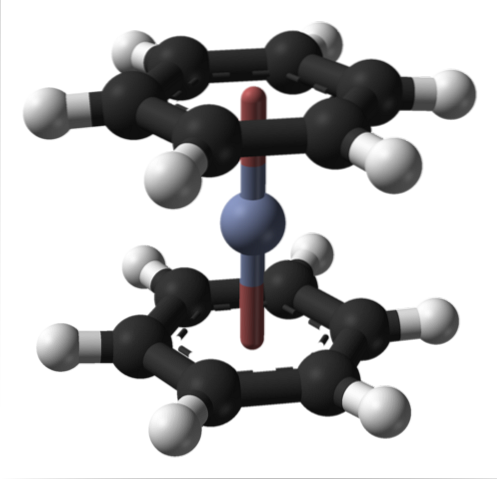
Da questi due composti organometallici molti altri possono derivare da Cr (0).
I sali sono stati trovati dove interagiscono con i cationi di sodio, il che implica che Cr deve avere un numero di ossidazione negativo per attrarre cariche positive: Cr (-2), NaDue[Cr (CO)5] e Cr (-1), NaDue[CrDue(CO)10].
Cr (I) e Cr (II)
Cr (I) o Cr1+ È prodotto dall'ossidazione dei composti organometallici appena descritti. Ciò si ottiene ossidando ligandi, come CN o NO, formando così, ad esempio, il composto K3[Cr (CN)5NON].
Ecco il fatto di avere tre cationi K.+ Implica che il complesso di cromo abbia tre cariche negative; anche il ligando CN- contribuisce con cinque cariche negative, in modo che tra Cr e NO si debbano aggiungere due cariche positive (-5 + 2 = -3).
Se l'NO è neutro, allora è Cr (II), ma se ha una carica positiva (NO+), è in tal caso Cr (I).
D'altra parte, i composti di Cr (II) sono più abbondanti, inclusi i seguenti: cloruro di cromo (II) (CrClDue), acetato di cromo (CrDue(ODueCCH3)4), ossido di cromo (II) (CrO), solfuro di cromo (II) (CrS) e altro.
Cr (III)
Tra tutti, è quello con la maggiore stabilità, poiché è infatti il prodotto di molte reazioni ossidative di ioni cromati. Forse la sua stabilità è dovuta alla sua configurazione elettronica d3, in cui tre elettroni occupano tre orbitali d a bassa energia rispetto agli altri due più energetici (scissione di d orbitali).
Il composto più rappresentativo di questo numero di ossidazione è l'ossido di cromo (III) (CrDueO3). A seconda dei ligandi che si coordinano ad esso, il complesso mostrerà un colore o un altro. Esempi di questi composti sono: [CrClDue(H.DueO)4] Cl, Cr (OH)3, CrF3, [Cr (HDueO)6]3+, eccetera.
Sebbene la formula chimica non lo mostri a prima vista, il cromo di solito ha una sfera di coordinazione ottaedrica nei suoi complessi; cioè si trova al centro di un ottaedro dove i suoi vertici sono posizionati dai ligandi (sei in totale).
Cr (IV) e Cr (V)
I composti a cui partecipa Cr5+ sono pochissimi, a causa dell'instabilità elettronica di detto atomo, oltre ad essere facilmente ossidabili a Cr6+, molto più stabile in quanto isoelettronico rispetto al gas nobile argon.
Tuttavia, i composti di Cr (V) possono essere sintetizzati in determinate condizioni, come l'alta pressione. Allo stesso modo, tendono a decomporsi a temperature moderate, il che rende impossibili le loro possibili applicazioni in quanto non hanno resistenza termica. Alcuni di loro sono: CrF5 e K3[Cr (ODue)4] (l'ODueDue- è l'anione perossido).
D'altra parte il Cr4+ è relativamente più stabile, potendo sintetizzare i suoi composti alogenati: CrF4, CrCl4 e CrBr4. Tuttavia, sono anche suscettibili di essere decomposti dalle reazioni redox per produrre atomi di cromo con migliori numeri di ossidazione (come +3 o +6)..
Cr (VI): la coppia cromato-bicromato
2 [CrO4]Due- + 2H+ (Giallo) => [CrDueO7]Due- + HDueO (arancione)
L'equazione di cui sopra corrisponde alla dimerizzazione acida di due ioni cromato per produrre bicromato. La variazione del pH provoca un cambiamento nelle interazioni attorno al centro metallico di Cr6+, evidente anche nel colore della soluzione (dal giallo all'arancio o viceversa). Il dicromato è costituito da un ponte O3Cr-O-CrO3.
I composti di Cr (VI) hanno le caratteristiche di essere nocivi e persino cancerogeni per il corpo umano e gli animali.
Come? Gli studi sostengono che gli ioni CrO4Due- membrane cellulari incrociate per azione delle proteine trasportatrici di solfati (entrambi gli ioni sono infatti di dimensioni simili).
Gli agenti riducenti all'interno delle cellule riducono il Cr (VI) in Cr (III), che si accumula coordinandosi irreversibilmente a siti specifici sulle macromolecole (come il DNA).
Contaminata la cellula da un eccesso di cromo, non può partire per la mancanza del meccanismo che la trasporta indietro attraverso le membrane.
Chromium utilizza
Come colorante o pigmenti
Il cromo ha una vasta gamma di applicazioni, dal colorante per diversi tipi di tessuti, al protettore che abbellisce le parti metalliche in quella che è nota come cromatura, che può essere realizzato con metallo puro, o con composti di Cr (III) o Cr (VI).
Fluoruro cromico (CrF3), ad esempio, viene utilizzato come colorante per panni di lana; solfato cromico (CrDue(SW4)3), si usa per colorare smalti, ceramiche, pitture, inchiostri, vernici, e si usa anche per cromare i metalli; e ossido cromico (CrDueO3) trova impiego anche dove è richiesto il suo attraente colore verde.
Pertanto, qualsiasi minerale di cromo con colori intensi può essere destinato a macchiare una struttura, ma dopo di ciò sorge il fatto se questi composti sono pericolosi o meno per l'ambiente o per la salute delle persone.
Infatti, le sue proprietà velenose vengono utilizzate per preservare il legno e altre superfici dall'attacco degli insetti..
In cromo o metallurgia
All'acciaio vengono inoltre aggiunte piccole quantità di cromo per rafforzarlo contro l'ossidazione e per migliorarne la lucentezza. Questo perché è in grado di formare carburi grigiastri (Cr3CDue) molto resistente alla reazione con l'ossigeno presente nell'aria.
Poiché il cromo può essere lucidato su superfici lucide, il cromo presenta quindi design e colori argento come alternativa più economica per questi scopi..
Nutrizionale
Alcuni discutono se il cromo possa essere considerato un elemento essenziale, cioè indispensabile nella dieta quotidiana. È presente in alcuni alimenti in concentrazioni molto piccole, come foglie verdi e pomodori..
Allo stesso modo, ci sono integratori proteici che regolano l'attività dell'insulina e promuovono la crescita muscolare, come nel caso del cromo polinicotinato.
Dove si trova?

Il cromo si trova in un'ampia varietà di minerali e gemme come rubini e smeraldi. Il principale minerale da cui si estrae il cromo è la cromite (MCrDueO4), dove M può essere qualsiasi altro metallo a cui è associato l'ossido di cromo. Queste miniere abbondano in Sud Africa, India, Turchia, Finlandia, Brasile e altri paesi.
Ogni sorgente ha una o più varianti di cromite. In questo modo, per ogni M (Fe, Mg, Mn, Zn, ecc.) Nasce un minerale di cromo diverso.
Per estrarre il metallo è necessario ridurre il minerale, cioè fare in modo che il centro metallico del cromo acquisisca elettroni per azione di un agente riducente. Questo è fatto con carbonio o alluminio:
FeCrDueO4 + 4C => Fe + 2Cr + 4CO
Inoltre, la cromite (PbCrO4).
Generalmente, in qualsiasi minerale in cui lo ione Cr3+ può sostituire Al3+, entrambi con raggi ionici leggermente simili, costituiscono un'impurità che si traduce in un'altra fonte naturale di questo incredibile, ma dannoso, metallo.
Riferimenti
- Tenenbaum E. Cromo. Tratto da: chemistry.pomona.edu
- Wikipedia. (2018). Cromo. Tratto da: en.wikipedia.org
- Anne Marie Helmenstine, Ph.D. (6 aprile 2018). Qual è la differenza tra Chrome e Chromium? Tratto da: thoughtco.com
- N.V. Mandich. (Millenovecentonovantacinque). Chimica del cromo. [PDF]. Tratto da: citeseerx.ist.psu.edu
- Chemistry LibreTexts. Chimica del cromo. Tratto da: chem.libretexts.org
- Saul 1. Shupack. (1991). La chimica del cromo e alcuni problemi analitici che ne derivano. Revisionato da: ncbi.nlm.nih.gov
- Advameg, Inc. (2018). Cromo. Tratto da: chemistryexplained.com


Nessun utente ha ancora commentato questo articolo.