
Struttura, proprietà e usi dell'idrossido di ammonio
Il Idrossido d'ammonio è un composto con formula molecolare NH4Oh, oh5NO prodotto dalla dissoluzione del gas ammoniacale (NH3) in acqua. Per questo motivo si chiama acqua ammoniacale o ammoniaca liquida..
È un liquido incolore con un odore molto intenso e pungente, che non è isolabile. Queste caratteristiche hanno una relazione diretta con la concentrazione di NH3 sciolto in acqua; concentrazione che infatti, essendo un gas, può racchiuderne enormi quantità disciolte in un piccolo volume d'acqua.
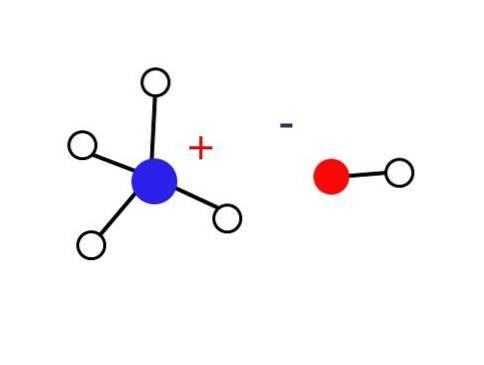
Una parte considerevolmente piccola di queste soluzioni acquose è composta da cationi NH.4+ e gli anioni OH-. D'altra parte, in soluzioni molto diluite o in solidi congelati a temperature molto basse, l'ammoniaca si può trovare sotto forma di idrati, come: NH3∙ H.DueOppure 2NH3∙ H.DueO e NH3∙ 2HDueO.
Come fatto curioso, le nuvole di Giove sono costituite da soluzioni diluite di idrossido di ammonio. Tuttavia, la sonda spaziale Galileo non è riuscita a trovare l'acqua nelle nuvole del pianeta, cosa che ci si aspetterebbe a causa della conoscenza che abbiamo della formazione di idrossido di ammonio; cioè, sono cristalli NH4OH totalmente anidro.
Lo ione ammonio (NH4+) è prodotto nel lume tubulare renale dall'unione di ammoniaca e idrogeno, secreto dalle cellule tubulari renali. Allo stesso modo, l'ammoniaca viene prodotta nelle cellule tubulari renali nel processo di trasformazione della glutammina in glutammato e, a sua volta, nella conversione del glutammato in α-chetoglutarato.
L'ammoniaca viene prodotta industrialmente con il metodo Haber-Bosch, in cui vengono fatti reagire azoto e idrogeno gassoso; utilizzando ioni ferrici, ossido di alluminio e ossido di potassio come catalizzatori. La reazione viene condotta ad alte pressioni (150-300 atmosfere) e alte temperature (400-500 ºC), con una resa del 10-20%.
L'ammoniaca viene prodotta nella reazione, che quando si ossida produce nitriti e nitrati. Questi sono essenziali per ottenere acido nitrico e fertilizzanti come il nitrato di ammonio..
Indice articolo
- 1 Struttura chimica
- 1.1 Ghiaccio ammoniacale
- 2 Proprietà fisiche e chimiche
- 2.1 Formula molecolare
- 2.2 Peso molecolare
- 2.3 Aspetto
- 2.4 Concentrazione
- 2.5 Odore
- 2.6 Aroma
- 2.7 Valore di soglia
- 2.8 Punto di ebollizione
- 2.9 Solubilità
- 2.10 Solubilità in acqua
- 2.11 Densità
- 2.12 Densità del vapore
- 2.13 Pressione di vapore
- 2.14 Azione corrosiva
- 2,15 pH
- 2.16 Costante di dissociazione
- 3 Nomenclatura
- 4 Solubilità
- 5 Rischi
- 5.1 Reattività
- 6 Usi
- 6.1 Nel cibo
- 6.2 Terapie
- 6.3 Industriale e varie
- 6.4 In agricoltura
- 7 Riferimenti
Struttura chimica
Come indica la sua definizione, l'idrossido di ammonio è costituito da una soluzione acquosa di ammoniaca gassosa. Pertanto, all'interno del liquido, non esiste una struttura definita diversa da quella di una disposizione casuale di ioni NH.4+ e OH- solvatato da molecole d'acqua.
Gli ioni ammonio e idrossile sono prodotti di un equilibrio di idrolisi dell'ammoniaca, quindi è comune che queste soluzioni abbiano un odore pungente:
NH3(g) + HDueO (l) <=> NH4+(ac) + OH-(AC)
Secondo l'equazione chimica, una forte diminuzione della concentrazione di acqua sposterebbe l'equilibrio alla formazione di più ammoniaca; cioè, quando l'idrossido di ammonio viene riscaldato, i vapori di ammoniaca verranno rilasciati.
Per questo motivo, gli ioni NH4+ e OH- non riescono a formare un cristallo in condizioni terrestri, il che si traduce nella base solida NH4Oh non esistere.
Detto solido dovrebbe essere composto solo da ioni interagenti elettrostaticamente (come mostrato nell'immagine).
Ghiaccio di ammoniaca
Tuttavia, a temperature ben al di sotto di 0ºC e circondate da enormi pressioni, come quelle prevalenti nei nuclei delle lune ghiacciate, l'ammoniaca e l'acqua gelano. In tal modo, si cristallizzano in una miscela solida con vari rapporti stechiometrici, il più semplice dei quali è NH3∙ H.DueO: ammoniaca monoidrato.
NH3∙ H.DueO e NH3∙ 2HDueOppure sono il ghiaccio di ammoniaca, poiché il solido è costituito da una disposizione cristallina di molecole di acqua e ammoniaca legate da legami idrogeno..
Dato un cambiamento in T e P, secondo studi computazionali che simulano tutte le variabili fisiche e i loro effetti su questi ghiacci, si verifica una transizione di una fase NH.3∙ nHDueO a una fase NH4Oh.
Pertanto, solo in queste condizioni estreme NH4L'OH può esistere come prodotto di una protonazione all'interno del ghiaccio tra NH3 e l'HDueO:
NH3(s) + H.DueVoi) <=> NH4Oh s)
Si noti che questa volta, a differenza dell'idrolisi dell'ammoniaca, le specie coinvolte si trovano in una fase solida. Un ghiaccio ammoniacale che diventa salato senza il rilascio di ammoniaca.
Proprietà fisiche e chimiche
Formula molecolare
NH4Oh, oh5NON
Peso molecolare
35,046 g / mol
Aspetto
È un liquido incolore.
Concentrazione
Fino a circa il 30% (per gli ioni NH4+ e OH-).
Odore
Molto forte e tagliente.
Gusto
Acre.
Valore di soglia
34 ppm per rilevamento aspecifico.
Punto di ebollizione
38 ºC (25%).
Solubilità
Esiste solo in soluzione acquosa.
Solubilità dell'acqua
Miscibile in proporzioni illimitate.
Densità
0,90 g / cm3 a 25 ºC.
Densità del vapore
Rispetto all'aria presa come unità: 0.6. Cioè, è meno denso dell'aria. Tuttavia, logicamente il valore riportato si riferisce all'ammoniaca come gas, non alle sue soluzioni acquose o NH4Oh.
Pressione del vapore
2.160 mmHg a 25 ºC.
Azione corrosiva
È in grado di sciogliere lo zinco e il rame.
pH
11,6 (soluzione 1N); 11.1 (soluzione 0.1 N) e 10,6 (soluzione 0,01 N).
Costante di dissociazione
pKb = 4,767; Kb = 1,71 x 10-5 a 20 ºC
pKb = 4,751; Kb = 1,774 x 10-5 a 25ºC.
L'aumento della temperatura aumenta in modo quasi impercettibile la basicità dell'idrossido di ammonio.
Nomenclatura
Quali sono tutti i nomi comuni e ufficiali che NH riceve?4OH? Secondo quanto stabilito dalla IUPAC, il suo nome è idrossido di ammonio perché contiene l'anione idrossile.
L'ammonio, a causa della sua carica +1, è monovalente, quindi usando la nomenclatura Stock viene chiamato: idrossido di ammonio (I).
Sebbene l'uso del termine idrossido di ammonio sia tecnicamente errato, poiché il composto non è isolabile (almeno non sulla Terra, come spiegato in dettaglio nella prima sezione).
Inoltre, l'idrossido di ammonio è chiamato acqua di ammoniaca e ammoniaca liquida..
Solubilità
NH4L'OH non esiste come sale in condizioni terrestri, non si può stimare quanto sia solubile in diversi solventi.
Tuttavia, ci si aspetterebbe che sia estremamente solubile in acqua, poiché la sua dissoluzione rilascerebbe enormi quantità di NH3. Teoricamente, sarebbe un modo fantastico per immagazzinare e trasportare l'ammoniaca.
In altri solventi in grado di accettare legami idrogeno, come alcoli e ammine, ci si potrebbe aspettare che sia anche molto solubile in essi. Qui il catione NH4+ è un donatore di legami idrogeno e OH- agisce come entrambi.
Esempi di queste interazioni con il metanolo sarebbero: H.3N+-H - OHCH3 e HO- - HOCH3 (OHCH3 indica che l'ossigeno riceve il legame idrogeno, non che il gruppo metile è legato all'H).
Rischi
-A contatto con gli occhi provoca irritazioni che possono provocare danni agli occhi..
-È corrosivo. Pertanto, a contatto con la pelle può provocare irritazione e ad alte concentrazioni del reagente, provoca ustioni cutanee. Il contatto ripetuto dell'idrossido di ammonio con la pelle può causare secchezza, prurito e arrossamento (dermatite)..
-L'inalazione di nebbia di idrossido di ammonio può causare irritazione acuta delle vie respiratorie, caratterizzata da soffocamento, tosse o mancanza di respiro. L'esposizione prolungata o ripetuta alla sostanza può provocare infezioni bronchiali ricorrenti. Inoltre, l'inalazione di idrossido di ammonio può causare irritazione ai polmoni..
-L'esposizione ad alte concentrazioni di idrossido di ammonio potrebbe costituire un'emergenza medica poiché può verificarsi un accumulo di liquidi nei polmoni (edema polmonare)..
-La concentrazione di 25 ppm è stata presa come limite di esposizione, in un turno lavorativo di 8 ore, in un ambiente dove il lavoratore è esposto all'azione dannosa dell'idrossido di ammonio.
Reattività
-Oltre al potenziale danno alla salute derivante dall'esposizione all'idrossido di ammonio, ci sono altre precauzioni che devono essere prese in considerazione quando si lavora con la sostanza..
-L'idrossido di ammonio può reagire con molti metalli, come: argento, rame, piombo e zinco. Inoltre reagisce con i sali di questi metalli per formare composti esplosivi e rilasciare idrogeno gassoso; che a sua volta è infiammabile ed esplosivo.
-Può reagire violentemente con acidi forti, ad esempio: acido cloridrico, acido solforico e acido nitrico. Inoltre reagisce allo stesso modo con dimetilsolfato e alogeni..
-Reagisce con basi forti, come idrossido di sodio e idrossido di potassio, producendo gas di ammoniaca. Ciò può essere verificato osservando l'equilibrio in soluzione, in cui l'aggiunta di ioni OH- sposta l'equilibrio alla formazione di NH3.
-I metalli di rame e alluminio, così come altri metalli zincati, non devono essere utilizzati quando si maneggia l'idrossido di ammonio, a causa della sua azione corrosiva su di essi..
Applicazioni
Nel cibo
-È usato come additivo in molti alimenti in cui agisce come agente lievitante, controllo del pH e agente di finitura per la superficie degli alimenti..
-L'elenco degli alimenti in cui viene utilizzato l'idrossido di ammonio è ampio e comprende prodotti da forno, formaggi, cioccolatini, caramelle e budini..
-L'idrossido di ammonio è elencato come sostanza sicura dalla FDA per la lavorazione degli alimenti, a condizione che vengano seguiti gli standard stabiliti..
-Nei prodotti a base di carne viene utilizzato come agente antimicrobico, potendo eliminare batteri come E. coli, riducendolo a livelli non rilevabili. I batteri si trovano nell'intestino dei bovini, adattandosi all'ambiente acido. L'idrossido di ammonio, regolando il pH, ostacola la crescita batterica.
Therapeutics
-L'idrossido di ammonio ha diversi usi terapeutici, tra cui:
-La soluzione al 10% viene utilizzata come stimolante del riflesso respiratorio
-Esternamente viene utilizzato sulla pelle per curare punture e punture di insetti - Agisce nell'apparato digerente come antiacido e carminativo, cioè aiuta ad eliminare i gas.
Inoltre, è usato come rubefacente topico per il dolore muscoloscheletrico acuto e cronico. Come conseguenza dell'azione rubefacente dell'idrossido di ammonio, si verifica un aumento locale del flusso sanguigno, arrossamento e irritazione..
Industriale e varie
-Funziona per ridurre NOx (gas altamente reattivi come l'ossido nitrico (NO) e il biossido di azoto (NODue)) per le emissioni della batteria e la riduzione di NOx nelle emissioni al camino.
-È usato come plastificante; additivo per vernici e per il trattamento delle superfici.
-Aumenta la porosità del capello permettendo ai pigmenti della tintura di avere una maggiore penetrazione, che ottiene una finitura migliore.
-L'idrossido di ammonio viene utilizzato come agente antimicrobico nel trattamento delle acque reflue. Inoltre, è coinvolto nella sintesi della cloramina. Questa sostanza svolge una funzione simile al cloro nella depurazione dell'acqua delle piscine, avendo il vantaggio di essere meno tossica.
-Viene utilizzato come inibitore della corrosione nel processo di raffinazione del petrolio.
-Viene utilizzato come detergente in vari prodotti industriali e commerciali, essendo utilizzato su varie superfici, tra cui: acciaio inossidabile, porcellana, vetro e forno.
-Inoltre, è utilizzato nella produzione di detergenti, saponi, prodotti farmaceutici e inchiostri..
Nell'agricoltura
Sebbene non sia somministrato direttamente come fertilizzante, l'idrossido di ammonio svolge questa funzione. L'ammoniaca è prodotta dall'azoto atmosferico con il metodo Haber-Bosch e viene trasportata refrigerata al di sotto del suo punto di ebollizione (-33 ºC) nei luoghi di utilizzo.
L'ammoniaca in pressione viene iniettata, sotto forma di vapore, nel terreno dove reagisce immediatamente con l'acqua edafica e passa sotto forma di ammonio (NH4+), che viene trattenuto nei siti di scambio cationico del suolo. Inoltre, viene prodotto idrossido di ammonio. Questi composti sono una fonte di azoto.
Insieme al fosforo e al potassio, l'azoto costituisce la triade dei principali nutrienti vegetali essenziali per la loro crescita..
Riferimenti
- Ganong, W. F. (2002). Fisiologia medica. 19a edizione. Redazione del manuale moderno.
- A. D. Fortes, J. P. Brodholt, I. G. Wood e L. Vocadlo. (2001). Simulazione ab initio dell'ammoniaca monoidrato (NH3∙ H.DueO) e idrossido di ammonio (NH4OH). Istituto americano di fisica. J. Chem. Phys., Vol.115, No.15, 15.
- Helmenstine, Anne Marie, Ph.D. (6 febbraio 2017). Fatti dell'idrossido di ammonio. Estratto da: thoughtco.com
- Gruppo Pochteca. (2015). Idrossido d'ammonio. pochteca.com.mx
- NJ Health. (s.f.). Scheda informativa sulle sostanze pericolose: idrossido di ammonio. [PDF]. Estratto da: nj.gov
- Studente di chimica. (2018). Idrossido d'ammonio. Estratto da: chemistrylearner.com
- PubChem. (2018). Idrossido d'ammonio. Estratto da: pubchem.ncbi.nlm.nih.gov



Nessun utente ha ancora commentato questo articolo.