
Fattori e conseguenze di denaturazione delle proteine

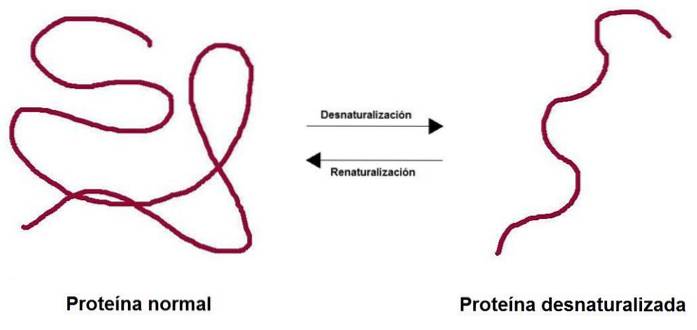
Il denaturazione delle proteine Consiste nella perdita della struttura tridimensionale dovuta a diversi fattori ambientali, come la temperatura, il pH o alcuni agenti chimici. La perdita della struttura comporta la perdita della funzione biologica associata a quella proteina, sia essa enzimatica, strutturale, trasportatrice, tra le altre..
La struttura della proteina è altamente sensibile ai cambiamenti. La destabilizzazione di un singolo legame idrogeno essenziale può denaturare la proteina. Allo stesso modo, ci sono interazioni che non sono strettamente essenziali per adempiere alla funzione delle proteine e, se destabilizzate, non hanno alcun effetto sulla funzione..
Indice articolo
- 1 Struttura delle proteine
- 1.1 Struttura primaria
- 1.2 Struttura secondaria
- 1.3 Struttura terziaria
- 1.4 Struttura quaternaria
- 2 Fattori che causano la denaturazione
- 2.1 pH
- 2.2 Temperatura
- 2.3 Sostanze chimiche
- 2.4 Agenti riducenti
- 3 conseguenze
- 3.1 Rinaturazione
- 4 proteine chaperone
- 5 Riferimenti
Struttura delle proteine
Per comprendere i processi di denaturazione delle proteine, dobbiamo sapere come sono organizzate le proteine. Questi presentano struttura primaria, secondaria, terziaria e quaternaria.
Struttura primaria
È la sequenza di amminoacidi che compongono detta proteina. Gli aminoacidi sono gli elementi costitutivi fondamentali che compongono queste biomolecole e ne esistono 20 tipi diversi, ciascuno con particolari proprietà fisiche e chimiche. Si legano tra loro tramite un legame peptidico.
Struttura secondaria
In questa struttura questa catena lineare di amminoacidi inizia a piegarsi attraverso i legami idrogeno. Ci sono due strutture secondarie di base: l'elica α, con una forma a spirale; e il foglio piegato β, quando due catene lineari sono allineate in parallelo.
Struttura terziaria
Coinvolge altri tipi di forze che si traducono in pieghe specifiche della forma tridimensionale.
Le catene R dei residui amminoacidici che compongono la struttura proteica possono formare ponti disolfuro e le parti idrofobiche delle proteine si aggregano all'interno, mentre quelle idrofile sono rivolte verso l'acqua. Le forze di van der Waals agiscono come stabilizzatori delle interazioni descritte.
Struttura quaternaria
È costituito da aggregati di unità proteiche.
Quando una proteina viene denaturata, perde la sua struttura quaternaria, terziaria e secondaria, mentre la primaria rimane intatta. Le proteine ricche di legami disolfuro (struttura terziaria) forniscono una maggiore resistenza alla denaturazione.
Fattori che causano la denaturazione
Qualsiasi fattore che destabilizzi i legami non covalenti responsabili del mantenimento della struttura nativa della proteina può provocarne la denaturazione. Tra i più importanti possiamo citare:
pH
A valori di pH molto estremi, sia acidi che basici, la proteina può perdere la sua configurazione tridimensionale. Ioni H in eccesso+ e OH- al centro destabilizza le interazioni proteiche.
Questo cambiamento nel pattern ionico causa la denaturazione. La denaturazione mediante pH può essere reversibile in alcuni casi e irreversibile in altri.
Temperatura
La denaturazione termica avviene con l'aumentare della temperatura. Negli organismi che vivono in condizioni ambientali medie, le proteine iniziano a destabilizzarsi a temperature superiori a 40 ° C. Chiaramente, le proteine degli organismi termofili possono resistere a questi intervalli di temperatura..
L'aumento della temperatura si traduce in un aumento dei movimenti molecolari che influenzano i legami idrogeno e altri legami non covalenti, con conseguente perdita della struttura terziaria..
Questi aumenti di temperatura portano ad una diminuzione della velocità di reazione, se parliamo di enzimi.
Sostanze chimiche
Le sostanze polari - come l'urea - in alte concentrazioni influenzano i legami idrogeno. Allo stesso modo, le sostanze non polari possono avere conseguenze simili..
I detersivi possono anche destabilizzare la struttura proteica; tuttavia, non è un processo aggressivo e sono per lo più reversibili.
Agenti riducenti
Il Β-mercaptoetanolo (HOCH2CH2SH) è un agente chimico spesso utilizzato in laboratorio per denaturare le proteine. È responsabile della riduzione dei ponti disolfuro tra i residui di amminoacidi. Può destabilizzare la struttura terziaria o quaternaria della proteina.
Un altro agente riducente con funzioni simili è il ditiotreitolo (DTT). Inoltre, altri fattori che contribuiscono alla perdita della struttura nativa nelle proteine sono i metalli pesanti in alte concentrazioni e le radiazioni ultraviolette..
Conseguenze
Quando si verifica la denaturazione, la proteina perde la sua funzione. Le proteine funzionano in modo ottimale quando sono nel loro stato nativo.
La perdita di funzione non è sempre associata a un processo di denaturazione. Può essere che un piccolo cambiamento nella struttura della proteina porti alla perdita di funzione senza destabilizzare l'intera struttura tridimensionale.
Il processo può o non può essere irreversibile. In laboratorio, se le condizioni sono invertite, la proteina può tornare alla sua configurazione iniziale.
Rinaturazione
Uno degli esperimenti più famosi e conclusivi sulla rinaturazione è stato evidenziato nella ribonucleasi A.
Quando i ricercatori hanno aggiunto agenti denaturanti come l'urea o il β-mercaptoetanolo, la proteina è stata denaturata. Se questi agenti venissero rimossi, la proteina tornerebbe alla sua conformazione originaria e potrebbe svolgere la sua funzione con un'efficienza del 100%..
Una delle conclusioni più importanti di questa ricerca è stata quella di dimostrare sperimentalmente che la conformazione tridimensionale della proteina è data dalla sua struttura primaria.
In alcuni casi, il processo di denaturazione è totalmente irreversibile. Ad esempio, quando cuciniamo un uovo stiamo applicando calore alle proteine (la principale è l'albumina) che lo costituiscono, il bianco assume un aspetto solido e biancastro. Intuitivamente possiamo concludere che, anche se lo raffreddiamo, non tornerà alla sua forma iniziale.
Nella maggior parte dei casi, il processo di denaturazione è accompagnato da una perdita di solubilità. Inoltre riduce la viscosità, la velocità di diffusione e cristallizza più facilmente..
Chaperone proteine
Le proteine chaperon o chaperonine hanno il compito di prevenire la denaturazione di altre proteine. Reprimono anche alcune interazioni non adatte tra le proteine per garantire il corretto ripiegamento delle stesse..
Quando la temperatura del mezzo aumenta, queste proteine aumentano la loro concentrazione e agiscono per prevenire la denaturazione di altre proteine. Questo è il motivo per cui sono anche chiamate "proteine da shock termico" o HSP per il suo acronimo in inglese. (Proteine da shock termico).
Le chaperonine sono analoghe a una gabbia o un barile che protegge la proteina di interesse all'interno.
Queste proteine che rispondono a situazioni di stress cellulare sono state segnalate in vari gruppi di organismi viventi e sono altamente conservate. Esistono diverse classi di chaperonine e sono classificate in base al loro peso molecolare..
Riferimenti
- Campbell, N. A. e Reece, J. B. (2007). biologia. Panamerican Medical Ed..
- Devlin, T. M. (2004). Biochimica: libro di testo con applicazioni cliniche. Invertito.
- Koolman, J., & Röhm, K. H. (2005). Biochimica: testo e atlante. Panamerican Medical Ed..
- Melo, V., Ruiz, V. M. e Cuamatzi, O. (2007). Biochimica dei processi metabolici. Reverte.
- Pacheco, D., & Leal, D. P. (2004). Biochimica medica. Editoriale Limusa.
- Pena, A., Arroyo, A., Gómez, A. e Tapia, R. (1988). Biochimica. Editoriale Limusa.
- Sadava, D., & Purves, W. H. (2009). Vita: la scienza della biologia. Panamerican Medical Ed..
- Tortora, G. J., Funke, B. R. e Case, C. L. (2007). Introduzione alla microbiologia. Panamerican Medical Ed..
- Voet, D., Voet, J. G. e Pratt, C. W. (2007). Fondamenti di biochimica. Panamerican Medical Ed..



Nessun utente ha ancora commentato questo articolo.