
Struttura, classificazione, funzione e importanza delle dita di zinco
Il dita di zinco (ZF) sono motivi strutturali presenti in un gran numero di proteine eucariotiche. Appartengono al gruppo delle metalloproteine, in quanto sono in grado di legare lo ione metallo zinco, di cui necessitano per il loro funzionamento. Si prevede che esistano più di 1.500 domini ZF in circa 1.000 diverse proteine nell'uomo..
Il termine dito di zinco o "dito di zinco" è stato coniato per la prima volta nel 1985 da Miller, McLachlan e Klug, mentre studiavano in dettaglio i piccoli domini di legame del DNA del fattore trascrizionale TFIIIA di Xenopus laevis, descritto da altri autori alcuni anni prima.
Le proteine con motivi ZF sono tra le più abbondanti nel genoma degli organismi eucariotici e partecipano a una varietà di processi cellulari essenziali, tra cui la trascrizione genica, la traduzione delle proteine, il metabolismo, il ripiegamento e l'assemblaggio di altre proteine e lipidi., Morte cellulare programmata, tra altri.
Indice articolo
- 1 Struttura
- 2 Classificazione
- 2.1 C2H2
- 2.2 C2H
- 2.3 C4 (arco o nastro)
- 2.4 C4 (famiglia GATA)
- 2.5 C6
- 2.6 Dita in zinco (C3HC4-C3H2C3)
- 2.7 H2C2
- 3 funzioni
- 4 Importanza biotecnologica
- 5 Riferimenti
Struttura
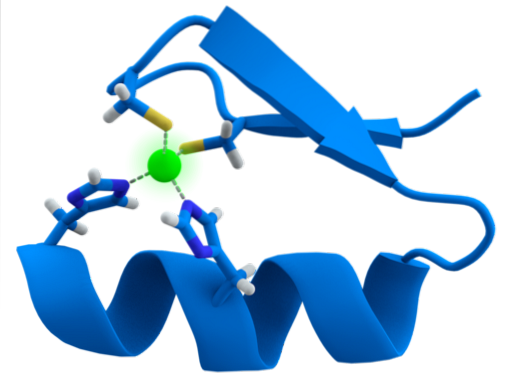
La struttura dei motivi ZF è estremamente conservata. Di solito queste regioni ripetute hanno da 30 a 60 aminoacidi, la cui struttura secondaria si trova come due fogli beta antiparalleli che formano una forcina e un'elica alfa, che è denotata come ββα.
Detta struttura secondaria è stabilizzata dalle interazioni idrofobiche e dalla coordinazione di un atomo di zinco dato da due residui di cisteina e due di istidina (CysDueIl suoDue). Tuttavia, ci sono ZF che possono coordinare più di un atomo di zinco e altri in cui varia l'ordine dei residui Cys e His..
Gli ZF possono essere trovati ripetuti in lotti, configurati linearmente nella stessa proteina. Tutti hanno strutture simili, ma possono essere differenziati chimicamente l'uno dall'altro per variazioni dei residui amminoacidici fondamentali per l'adempimento delle loro funzioni.
Una caratteristica comune tra le ZF è la loro capacità di riconoscere molecole di DNA o RNA di diverse lunghezze, motivo per cui inizialmente erano considerate solo come fattori trascrizionali.
In generale, il riconoscimento è di regioni 3bp nel DNA e si ottiene quando la proteina con dominio ZF presenta l'alfa elica al solco principale della molecola di DNA.
Classificazione
Esistono diversi motivi ZF che differiscono tra loro per la loro natura e per le diverse configurazioni spaziali raggiunte dai legami di coordinazione con l'atomo di zinco. Una delle classificazioni è la seguente:
CDueHDue
Questo è un motivo che si trova comunemente negli ZF. La maggior parte dei motivi C.DueHDue Sono specifici per l'interazione con DNA e RNA, tuttavia, è stato osservato che partecipano alle interazioni proteina-proteina. Hanno tra 25 e 30 residui di amminoacidi e si trovano all'interno della più grande famiglia di proteine regolatrici nelle cellule di mammifero.
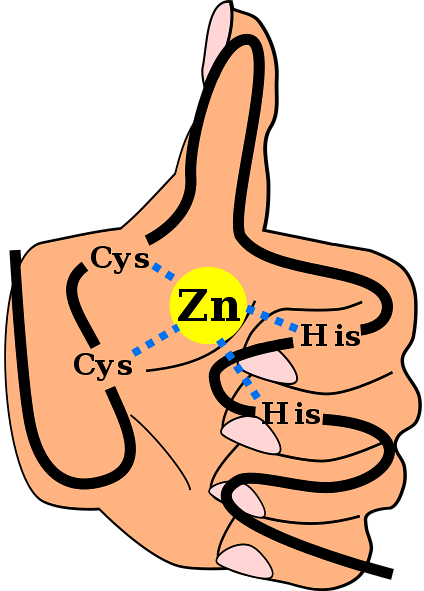
CDueH
Interagiscono con l'RNA e alcune altre proteine. Sono osservati principalmente come parte di alcune proteine del capside retrovirus, che aiutano nel confezionamento dell'RNA virale subito dopo la replicazione..
C4 (fiocco o nastro)
Le proteine con questo motivo sono enzimi responsabili della replicazione e della trascrizione del DNA. Un buon esempio di questi possono essere gli enzimi grossolani dei fagi T4 e T7.
C4 (Famiglia GATA)
Questa famiglia ZF comprende fattori di trascrizione che regolano l'espressione di geni importanti in numerosi tessuti durante lo sviluppo cellulare. I fattori GATA-2 e 3, ad esempio, sono coinvolti nell'emopoiesi.
C6
Questi domini sono tipici dei lieviti, in particolare la proteina GAL4, che attiva la trascrizione dei geni coinvolti nell'uso del galattosio e del melibio..
Dita di zinco (C.3HC4-C3HDueC3)
Queste particolari strutture possiedono 2 sottotipi di domini ZF (C.3HC4 e C3HDueC3) e sono presenti in numerose proteine animali e vegetali.
Si trovano in proteine come RAD5, coinvolte nella riparazione del DNA negli organismi eucariotici. Si trovano anche in RAG1, essenziale per la riconfigurazione delle immunoglobuline.
HDueCDue
Questo dominio di ZF è altamente conservato nelle integrasi di retrovirus e retrotrasposoni; legandosi alla proteina bersaglio provoca in essa un cambiamento conformazionale.
Caratteristiche
Le proteine con domini ZF servono a vari scopi: possono essere trovate nelle proteine ribosomiali o negli adattatori trascrizionali. Sono stati anche rilevati come parte integrante della struttura della RNA polimerasi II di lievito..
Sembrano essere coinvolti nell'omeostasi intracellulare dello zinco e nella regolazione dell'apoptosi o della morte cellulare programmata. Inoltre, ci sono alcune proteine con ZF che funzionano come accompagnatori per il ripiegamento o il trasporto di altre proteine..
Il legame ai lipidi e un ruolo fondamentale nelle interazioni proteina-proteina sono anche funzioni importanti dei domini ZF in alcune proteine..
Importanza biotecnologica
Negli anni, la comprensione strutturale e funzionale dei domini ZF ha consentito grandi progressi scientifici che comportano l'utilizzo delle loro caratteristiche a fini biotecnologici..
Poiché alcune proteine con ZF hanno un'elevata specificità per determinati domini del DNA, molti sforzi sono attualmente investiti nella progettazione di ZF specifici, che possono fornire preziosi progressi nella terapia genica negli esseri umani.
Interessanti applicazioni biotecnologiche derivano anche dalla progettazione di proteine con ZF geneticamente modificati. A seconda dello scopo desiderato, alcuni di questi possono essere modificati mediante l'aggiunta di peptidi a dito "poli zinco", che sono in grado di riconoscere virtualmente qualsiasi sequenza di DNA con elevata affinità e specificità..
L'editing genomico modificato da nucleasi è oggi una delle applicazioni più promettenti. Questo tipo di editing offre la possibilità di effettuare studi sulla funzione genetica direttamente nel sistema modello di interesse..
L'ingegneria genetica che utilizza nucleasi ZF modificate ha catturato l'attenzione degli scienziati nel campo del miglioramento genetico di cultivar di piante di importanza agronomica. Queste nucleasi sono state utilizzate per correggere un gene endogeno che produce forme resistenti agli erbicidi nelle piante di tabacco..
Le nucleasi con ZF sono state utilizzate anche per l'aggiunta di geni nelle cellule di mammifero. Le proteine in questione sono state utilizzate per generare un insieme di cellule di topo isogeniche con una serie di alleli definiti per un gene endogeno..
Tale processo ha un'applicazione diretta nell'etichettatura e nella creazione di nuove forme alleliche per studiare le relazioni di struttura e funzione in condizioni di espressione native e in ambienti isogenici..
Riferimenti
- Berg, J. M. (1990). Domini di zinco: ipotesi e conoscenze attuali. Revisione annuale di biofisica e chimica biofisica, 19(39), 405-421.
- Dreier, B., Beerli, R., Segal, D., Flippin, J., & Barbas, C. (2001). Sviluppo di domini zinc finger per il riconoscimento della famiglia 5'-ANN-3 'di sequenze di DNA e il loro utilizzo nella costruzione di fattori di trascrizione artificiale. JBC, (54).
- Gamsjaeger, R., Liew, C. K., Loughlin, F. E., Crossley, M. e Mackay, J. P. (2007). Dita appiccicose: dita di zinco come motivi di riconoscimento delle proteine. Tendenze nelle scienze biochimiche, 32(2), 63-70.
- Klug, A. (2010). La scoperta delle dita di zinco e delle loro applicazioni nella regolazione genica e nella manipolazione del genoma. Revisione annuale di biochimica, 79(1), 213-231.
- Kluska, K., Adamczyk, J. e Krȩzel, A. (2017). Proprietà leganti il metallo delle dita di zinco con un sito di legame metallico naturalmente alterato. Metallomica, 10(2), 248-263.
- Laity, J. H., Lee, B. M. e Wright, P. E. (2001). Proteine del dito di zinco: nuove conoscenze sulla diversità strutturale e funzionale. Parere attuale in Biologia strutturale, undici(1), 39-46.
- Miller, J., McLachlan, A. D. e Klug, A. (1985). Domini di legame dello zinco ripetitivi nel fattore di trascrizione proteica IIIA da ovociti di Xenopus. Journal of Trace Elements in Experimental Medicine, 4(6), 1609-1614.
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., & Gregory, P. D. (2010). Modifica del genoma con nucleasi a dita di zinco ingegnerizzate. Nature Reviews Genetics, undici(9), 636-646.


Nessun utente ha ancora commentato questo articolo.