
Meccanismi di corrosione galvanica, esempi, protezione
Il corrosione galvanica o elettrochimica È un processo mediante il quale un metallo o una lega si degrada più rapidamente rispetto alla sua ossidazione convenzionale. Si può dire che si tratta di un'ossidazione accelerata, e anche, intenzionalmente propiziata; come accade nelle celle o nelle batterie.
Ciò avviene in una serie di condizioni. Innanzitutto, deve esserci un metallo attivo, chiamato anodo. Inoltre, e in secondo luogo, deve esserci un metallo nobile a bassa reattività chiamato catodo. La terza e la quarta condizione sono la presenza di un mezzo in cui si propagano gli elettroni, come l'acqua, e le specie ioniche o gli elettroliti..

La corrosione galvanica è osservabile soprattutto in ambienti marini o sulle rive delle spiagge. Le correnti d'aria sollevano masse di vapore acqueo, che a loro volta trasportano alcuni ioni; questi ultimi finiscono per aderire ad un sottile strato di acqua o gocce che poggiano sulla superficie metallica.
Queste condizioni di umidità e salinità favoriscono la corrosione del metallo. Cioè, una corona di ferro come quella nell'immagine sopra arrugginirà più rapidamente se esposta in prossimità del mare..
La facilità che un metallo avrà di ossidarsi rispetto ad un altro può essere misurata quantitativamente attraverso i suoi potenziali di riduzione; i libri di chimica abbondano di tabelle con questi potenziali E. Più è negativo, maggiore è la sua inclinazione alla ruggine.
Allo stesso modo, se questo metallo è in presenza di un altro con un potenziale di riduzione molto positivo, avendo quindi un grande ΔE, l'ossidazione del metallo reattivo sarà più aggressiva. Sono importanti anche altri fattori, come il pH, la forza ionica, l'umidità, la presenza di ossigeno e la relazione tra le aree del metallo che si ossidano e quelle che si riducono..
Indice articolo
- 1 Meccanismi
- 1.1 Concetti e reazioni
- 1.2 Depolarizzatori
- 1.3 Corrosione del ferro
- 2 esempi
- 2.1 Indici anodici
- 3 Protezione contro la corrosione elettrochimica
- 3.1 Rivestimenti sacrificali
- 3.2 Rivestimenti nobili
- 4 Esperimento per bambini
- 4.1 Piastra di ferro in soluzione di sali di rame
- 4.2 Pulizia dell'ossido d'argento
- 5 Riferimenti
Meccanismi
Concetti e reazioni
Prima di affrontare i meccanismi alla base della corrosione galvanica, è necessario chiarire alcuni concetti.
In una reazione redox, una specie perde elettroni (si ossida) mentre un'altra li guadagna (riduce). L'elettrodo su cui avviene l'ossidazione è chiamato anodo; e su cui avviene la riduzione, catodo (in inglese la regola mnemonica redcat ricordare).
Quindi, per un elettrodo (un pezzo, una vite, ecc.) Di un metallo M, se si ossida si dice che sia l'anodo:
M => Mn+ + ne-
Il numero di elettroni rilasciati sarà uguale alla grandezza della carica positiva del catione Mn+ risultante.
Quindi un altro elettrodo o metallo R (entrambi i metalli devono essere in contatto in qualche modo), riceve gli elettroni rilasciati; ma questo non subisce una reazione chimica se guadagna elettroni, poiché li condurrebbe solo (corrente elettrica).
Pertanto, deve esserci un'altra specie in soluzione che può accettare formalmente questi elettroni; come ioni metallici facilmente ridotti, ad esempio:
Rn+ + ne- => R
Cioè, si formerebbe uno strato di metallo R e l'elettrodo diventerebbe quindi più pesante; mentre il metallo M perderebbe massa a causa della dissoluzione dei suoi atomi.
Depolarizzatori
E se non ci fossero cationi metallici che potrebbero essere ridotti abbastanza facilmente? In quel caso, altre specie presenti nel mezzo prenderanno gli elettroni: i depolarizzatori. Questi sono strettamente correlati al pH: ODue, H+, Oh- e H.DueO.
L'ossigeno e l'acqua guadagnano elettroni in una reazione espressa dalla seguente equazione chimica:
ODue + 2HDueO + 4e- => 4OH-
Mentre gli ioni H.+ trasformarsi in HDue:
2H+ + 2e- => HDue
Cioè, la specie OH- e H.Due sono prodotti comuni di corrosione galvanica o elettrochimica.
Anche se il metallo R non partecipa ad alcuna reazione, il fatto che sia più nobile di M ne favorisce l'ossidazione; e di conseguenza, ci sarà una maggiore produzione di ioni OH- o idrogeno gassoso. Perché, in fondo, è la differenza tra i potenziali di riduzione, ΔE, uno dei principali driver di questi processi.
Corrosione del ferro
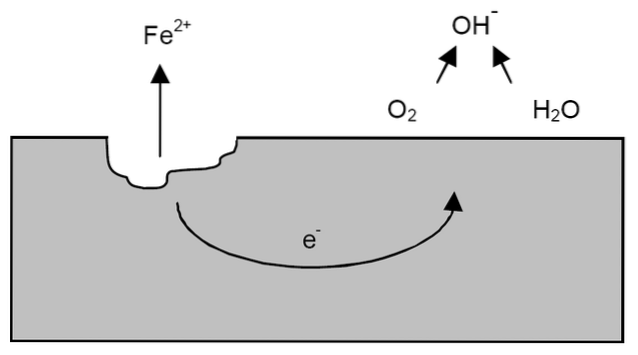
Dopo i chiarimenti precedenti si può affrontare l'esempio di corrosione del ferro (immagine in alto). Supponiamo che ci sia un sottile strato di acqua in cui l'ossigeno si dissolve. Senza la presenza di altri metalli, saranno i depolarizzatori a stabilire le linee guida per la reazione.
Pertanto, il ferro perderà alcuni atomi dalla sua superficie per dissolversi in acqua come cationi Fe.Due+:
Fede => FedeDue+ + 2e-
I due elettroni viaggeranno attraverso il pezzo di ferro perché è un buon conduttore di elettricità. Quindi si sa dove è iniziata l'ossidazione o il sito dell'anodo; ma non dove procederà la riduzione o la posizione del sito catodico. Il sito del catodo può essere ovunque; e maggiore è la sua area possibile, peggiore sarà la corrosione del metallo.
Supponiamo che gli elettroni raggiungano un punto come mostrato nell'immagine sopra. Sia l'ossigeno che l'acqua subiscono la reazione già descritta, mediante la quale viene rilasciato OH-. Questi anioni OH- può reagire con il FeDue+ per formare Fe (OH)Due, che precipita e subisce successive ossidazioni che lo trasformano infine in ruggine.
Nel frattempo, il sito dell'anodo si rompe sempre di più.
Esempi
Nella vita di tutti i giorni gli esempi di corrosione galvanica sono numerosi. Non dobbiamo fare riferimento alla corona in ferro: qualsiasi manufatto in metallo può subire la stessa lavorazione in presenza di ambienti umidi e salmastri.
Oltre alla spiaggia, l'inverno può fornire anche le condizioni ideali per la corrosione; ad esempio, quando si spalano i sali nella neve sulla strada per evitare che le auto slittino.
Dal punto di vista fisico, l'umidità può essere trattenuta nei giunti saldati di due metalli, essendo siti attivi di corrosione. Questo perché entrambi i metalli si comportano come due elettrodi e quello più reattivo perderà i suoi elettroni..
Se la produzione di ioni OH- È notevole, può persino corrodere la vernice dell'auto o del dispositivo in questione.
Indici anodici
Si possono costruire i propri esempi di corrosione galvanica utilizzando le tabelle dei potenziali di riduzione. Tuttavia, per illustrare questo punto verrà scelta la tabella degli indici anodici (semplificata di per sé)..
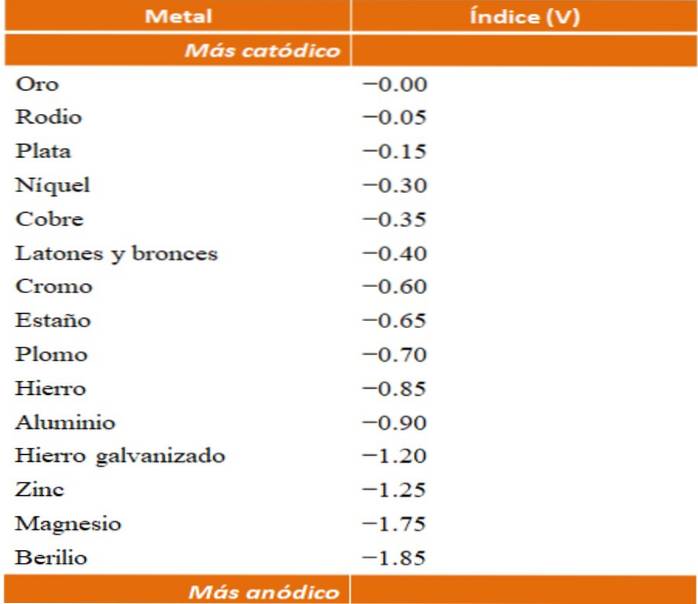
Supponiamo ad esempio di voler costruire una cella elettrochimica. I metalli che sono in cima alla tabella dell'indice anodico sono più catodici; cioè si riducono facilmente e sarà quindi difficile averli in soluzione. Mentre i metalli che si trovano nella parte inferiore sono più anodici o reattivi e si corrodono facilmente.
Se scegliamo l'oro e il berillio, entrambi i metalli non potrebbero stare insieme a lungo, poiché il berillio si ossiderebbe molto rapidamente..
E se, d'altra parte, abbiamo una soluzione di ioni Ag+ e vi immergiamo una barra di alluminio, questa si dissolverà nello stesso momento in cui precipiteranno le particelle di argento metallico. Se questa barra fosse collegata a un elettrodo di grafite, gli elettroni viaggerebbero su di essa per depositare elettrochimicamente argento su di essa come una pellicola d'argento..
E se invece della barra di alluminio fosse di rame, la soluzione diventerebbe bluastra per la presenza di ioni Cu.Due+ in acqua.
Protezione dalla corrosione elettrochimica
Rivestimenti sacrificali
Supponiamo di voler proteggere un foglio di zinco dalla corrosione in presenza di altri metalli. L'opzione più semplice sarebbe quella di aggiungere magnesio, che rivestirebbe lo zinco in modo che, una volta ossidati, gli elettroni rilasciati dal magnesio riducano i cationi Zn.Due+ indietro.
Tuttavia, il film di MgO sullo zinco finirebbe per rompersi prima o poi, fornendo siti anodici ad alta densità di corrente; cioè, la corrosione dello zinco accelererebbe bruscamente proprio in quei punti.
Questa tecnica di protezione dalla corrosione elettrochimica è nota come uso di rivestimenti sacrificali. Il più noto è lo zinco, utilizzato nella famosa tecnica chiamata zincatura. In essi, il metallo M, in particolare il ferro, è rivestito di zinco (Fe / Zn).
Anche in questo caso, lo zinco si ossida e il suo ossido serve a coprire il ferro e a trasmettergli elettroni che riducono il FeDue+ che può essere formato.
Rivestimenti nobili
Supponiamo di nuovo di voler proteggere lo stesso foglio di zinco, ma ora userete il cromo invece del magnesio. Il cromo è più nobile (più catodico, vedi tabella degli indici anodici) dello zinco e quindi funziona come rivestimento nobile.
Il problema con questo tipo di rivestimento è che una volta incrinato, promuoverà e accelererà ulteriormente l'ossidazione del metallo sottostante; in questo caso lo zinco si corroderebbe ancor più che rivestirsi di magnesio.
E infine, ci sono altri rivestimenti che consistono in vernici, plastica, antiossidanti, grassi, resine, ecc..
Esperimento per bambini
Piastra di ferro in dissoluzione di sali di rame
Un semplice esperimento può essere ideato dalla stessa tabella degli indici anodici. Sciogliere una quantità ragionevole (meno di 10 grammi) di CuSO45HDueO in acqua, a un bambino viene chiesto di immergersi in una lastra di ferro lucidato. Viene scattata una foto e il processo può svolgersi per un paio di settimane.
La soluzione è inizialmente bluastra, ma inizierà a sbiadire mentre la piastra di ferro assume un colore ramato. Questo perché il rame è più nobile del ferro, e quindi i suoi cationi CuDue+ Saranno ridotti a rame metallico dagli ioni dati dall'ossidazione del ferro:
Fede => FedeDue+ + 2e-
CuDue+ + 2e- => Cu
Pulizia con ossido d'argento
Gli oggetti d'argento si anneriscono nel tempo, soprattutto se vengono a contatto con una fonte di composti solforati. La sua ruggine può essere rimossa immergendo l'oggetto in una vasca d'acqua con bicarbonato di sodio e carta stagnola. Il bicarbonato fornisce gli elettroliti che faciliteranno il trasporto di elettroni tra l'oggetto e l'alluminio.
Di conseguenza, il bambino apprezzerà che l'oggetto perde le sue macchie nere e risplenderà del suo caratteristico colore argento; mentre il foglio di alluminio si corroderà per scomparire.
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Wikipedia. (2019). Corrosione galvanica. Estratto da: en.wikipedia.org
- Stephen Lower. (16 giugno 2019). Corrosione elettrochimica. Chemistry LibreTexts. Recupero da: chem.libretexts.org
- The Open University. (2018). 2.4 Processi di corrosione: corrosione galvanica. Recupero da: open.edu
- Spazzola per il servizio tecnico clienti Wellman Inc. (s.f.). Una guida alla corrosione galvanica. Pennello Wellman Engineered Materials.
- Giorgio Carboni. (1998). Esperimenti in elettrochimica. Estratto da: funsci.com



Nessun utente ha ancora commentato questo articolo.