
Co-precipitazione in cosa consiste, tipi e applicazioni

Il co-precipitazione È la contaminazione di una sostanza insolubile che trasporta i soluti disciolti dal mezzo liquido. Qui la parola "contaminazione" viene applicata per quei casi in cui i soluti solubili precipitati da un supporto insolubile non sono desiderabili; ma quando non lo sono, un metodo analitico o sintetico alternativo è in mano.
D'altra parte, il supporto insolubile è la sostanza precipitata. Questo può trasportare il soluto solubile all'interno (assorbimento) o sulla sua superficie (adsorbimento). Il modo in cui lo fai cambierà completamente le proprietà fisico-chimiche del solido risultante..
Sebbene il concetto di co-precipitazione possa sembrare un po 'confuso, è più comune di quanto si possa pensare. Perché? Perché, più che semplici solidi contaminati, si formano soluzioni solide di strutture complesse e ricche di componenti inestimabili. Il terreno da cui si nutrono le piante sono esempi di co-precipitazione.
Allo stesso modo, anche minerali, ceramiche, argille e impurità nel ghiaccio sono il prodotto di questo fenomeno. Altrimenti i terreni perderebbero gran parte dei loro elementi essenziali, i minerali non sarebbero come sono attualmente conosciuti e non ci sarebbe un metodo importante per la sintesi di nuovi materiali..
Indice articolo
- 1 Cos'è la co-precipitazione?
- 2 tipi
- 2.1 Inclusione
- 2.2 Occlusione
- 2.3 Adsorbimento
- 3 Applicazioni
- 4 Riferimenti
Cos'è la co-precipitazione?
Per comprendere meglio l'idea di co-precipitazione, viene offerto il seguente esempio.
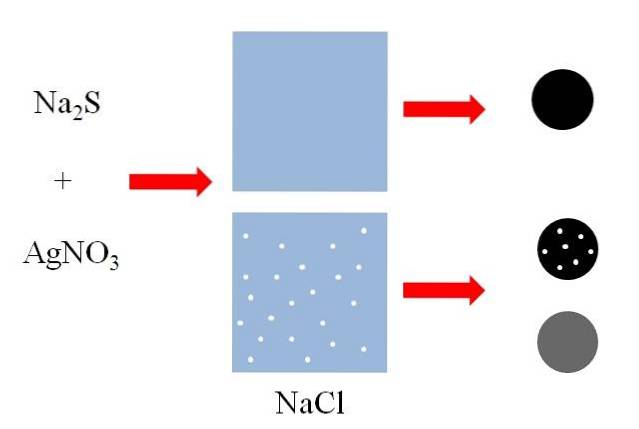
Sopra (immagine in alto) ci sono due contenitori con acqua, di cui uno contiene NaCl disciolto. NaCl è un sale altamente solubile in acqua, ma le dimensioni dei punti bianchi sono esagerate a scopo esplicativo. Ogni punto bianco diventerà piccoli aggregati di NaCl in una soluzione sull'orlo della saturazione.
Una miscela di solfuro di sodio, NaDueS e nitrato d'argento, AgNO3, precipiterà un solido nero insolubile di solfuro d'argento, AgS:
N / ADueS + AgNO3 => AgS + NaNO3
Come si può vedere nel primo contenitore d'acqua, precipita un solido nero (sfera nera). Tuttavia, questo solido nel contenitore con NaCl disciolto trasporta particelle di questo sale (sfera nera con punti bianchi). NaCl è solubile in acqua, ma quando l'AgS precipita, viene adsorbito sulla superficie nera.
Si dice poi che il NaCl coprecipitasse sull'AgS. Se il solido nero fosse analizzato, si potrebbero vedere micro cristalli di NaCl sulla superficie.
Tuttavia, questi cristalli potrebbero anche essere all'interno dell'AgS, quindi il solido "diventerebbe" grigiastro (bianco + nero = grigio).
Tipi
La sfera nera con punti bianchi e la sfera grigia mostrano che un soluto solubile può co-precipitare in modi diversi..
Nel primo lo fa superficialmente, adsorbito sul supporto insolubile (AgS nell'esempio precedente); mentre nella seconda lo fa internamente, "cambiando" il colore nero del precipitato.
Puoi ottenere altri tipi di solidi? Cioè, una sfera con fasi bianche e nere, cioè di AgS e NaCl (insieme a NaNO3 che coprecipita anche). È qui che nasce l'ingegnosità della sintesi di nuovi solidi e materiali.
Tuttavia, tornando al punto di partenza, fondamentalmente il soluto solubile coprecipita generando diversi tipi di solidi. I tipi di coprecipitazione e i solidi che ne derivano saranno menzionati di seguito..
Inclusione
Si parla di inclusione quando nel reticolo cristallino uno degli ioni può essere sostituito da uno della sostanza solubile co-precipitata.
Ad esempio, se NaCl fosse co-precipitato attraverso l'inclusione, gli ioni Na+ avrebbe preso il posto di Ag+ in una sezione della disposizione dei cristalli.
Tuttavia, di tutti i tipi di co-precipitazione, questa è la meno probabile; poiché, perché avvenga, i raggi ionici devono essere molto simili. Ritornando alla sfera grigia dell'immagine, l'inclusione verrebbe rappresentata da uno dei toni grigiastri più chiari.
Come appena accennato, l'inclusione avviene nei solidi cristallini, e per ottenerli è necessario avere padronanza della chimica delle soluzioni e di diversi fattori (T, pH, tempo di agitazione, rapporti molari, ecc.).
Occlusione
In occlusione, gli ioni vengono intrappolati all'interno del reticolo cristallino ma senza sostituire nessuno ione nella matrice. Ad esempio, i cristalli di NaCl occlusi possono formarsi all'interno di AgS. Graficamente, potrebbe essere visualizzato come un cristallo bianco circondato da cristalli neri.
Questo tipo di co-precipitazione è uno dei più comuni e grazie ad esso si ha la sintesi di nuovi solidi cristallini. Le particelle occluse non possono essere rimosse con un semplice lavaggio. Per fare ciò, sarebbe necessario ricristallizzare l'intero assieme, cioè il supporto insolubile.
Sia l'inclusione che l'occlusione sono processi di assorbimento dati nelle strutture cristalline.
Adsorbimento
All'adsorbimento, il solido coprecipitato giace sulla superficie del supporto insolubile. La dimensione delle particelle di questo supporto definisce il tipo di solido ottenuto.
Se sono piccoli si otterrà un solido coagulato, dal quale è facile rimuovere le impurità; ma se sono molto piccoli, il solido assorbirà abbondanti quantità di acqua e sarà gelatinoso.
Ritornando alla sfera nera con puntini bianchi, i cristalli di NaCl coprecipitati sull'AgS possono essere lavati con acqua distillata. Così via fino a quando l'AgS non viene purificato, che può quindi essere riscaldato per far evaporare tutta l'acqua.
Applicazioni
Quali sono le applicazioni della co-precipitazione? Alcuni di loro sono i seguenti:
-Permette di quantificare le sostanze solubili che non sono facilmente precipitate dal terreno. Quindi, attraverso un supporto insolubile, trasporta, ad esempio, isotopi radioattivi, come il francio, per ulteriori studi e analisi..
-Coprecipitando gli ioni nei solidi gelatinosi, stai purificando il mezzo liquido. L'occlusione è ancora più desiderabile in questi casi, poiché l'impurità non sarà in grado di sfuggire all'esterno.
-La coprecipitazione consente di incorporare sostanze nei solidi durante la loro formazione. Se il solido è un polimero, assorbirà i soluti solubili che poi co-precipiteranno all'interno, conferendogli nuove proprietà. Se è cellulosa, ad esempio, il cobalto (o altro metallo) potrebbe essere co-precipitato al suo interno.
-Oltre a tutto quanto sopra, la coprecipitazione è uno dei metodi chiave per la sintesi di nanoparticelle su un supporto insolubile. Grazie a ciò, sono stati sintetizzati bionanomateriali e nanoparticelle di magnetite, tra molti altri..
Riferimenti
- Day, R. e Underwood, A. (1986). Chimica analitica quantitativa (quinto ed.). PEARSON Prentice Hall.
- Wikipedia. (2018). Coprecipitazione. Estratto da: en.wikipedia.org
- NPTEL. (s.f.). Precipitazioni e Co-Precipitazioni. Recupero da: nptel.ac.in
- Wise Geek. (2018). Cos'è la coprecipitazione. Estratto da: wisegeek.com
- Wilson Sacchi Peternele, Victoria Monge Fuentes, Maria Luiza Fascineli, et al. (2014). Indagine sperimentale del metodo di coprecipitazione: un approccio per ottenere nanoparticelle di magnetite e maghemite con proprietà migliorate. Journal of Nanomaterials, vol. 2014, ID articolo 682985, 10 pagine.

Nessun utente ha ancora commentato questo articolo.