
Costruzione della configurazione elettronica del kernel, esempi
Il configurazione elettronica del kernel o compatto è quello le cui notazioni quantistiche per il numero di elettroni e i loro sottolivelli di energia sono abbreviate dai simboli dei gas nobili tra parentesi. È molto utile quando si scrivono configurazioni elettroniche per un determinato elemento, poiché è semplice e veloce.
La parola "kernel" di solito si riferisce ai gusci elettronici interni di un atomo; vale a dire quelli in cui i loro elettroni non sono di valenza e quindi non partecipano al legame chimico, sebbene definiscano le proprietà dell'elemento. Metaforicamente parlando, il nocciolo sarebbe l'interno della cipolla, con i suoi strati composti da una serie di orbitali che aumentano di energia.
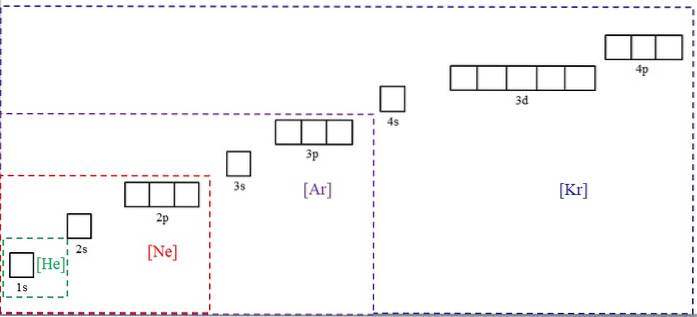
L'immagine sopra mostra i simboli chimici per quattro dei gas nobili tra parentesi e con diversi colori: [He] (verde), [Ne] (rosso), [Ar] (viola) e [Kr] (blu).
Ciascuna delle sue cornici tratteggiate contiene caselle che rappresentano gli orbitali. Più sono grandi, maggiore è il numero di elettroni che contengono; il che a sua volta significherà che le configurazioni elettroniche di più elementi potranno essere semplificate con questi simboli. Ciò consente di risparmiare tempo ed energia nella scrittura di tutte le annotazioni.
Indice articolo
- 1 Ordine di costruzione
- 2 Abbreviazione di configurazione elettronica
- 3 esempi
- 3.1 Generale
- 3.2 Ossigeno
- 3.3 Potassio
- 3.4 indiano
- 3.5 Tungsteno
- 4 Riferimenti
Ordine di costruzione
Prima di utilizzare le configurazioni elettroniche del kernel, è una buona idea rivedere l'ordine corretto per creare o scrivere queste configurazioni. Questo è governato secondo la regola delle diagonali o diagramma di Moeller (chiamato in alcune parti il metodo della pioggia). Avendo questo diagramma a portata di mano, le notazioni quantistiche sono le seguenti:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Questa stringa di notazioni quantistiche sembra faticosa; e lo sarebbe ancora di più se dovesse essere scritto ogni volta che verrà rappresentata la configurazione elettronica di qualsiasi elemento trovato nel periodo 5 in poi. Notare inoltre che la stringa è vuota di elettroni; non ci sono numeri negli angoli in alto a destra (1sDue2sDue2 P6...).
Va ricordato che gli orbitali S può "ospitare" due elettroni (nsDue). Orbitali p ce ne sono tre in totale (guarda le tre caselle sopra), quindi possono ospitare sei elettroni (np6). E infine, gli orbitali d ce ne sono cinque e il file F sette, per un totale di dieci (nd10) e quattordici (nf14) elettroni, rispettivamente.
Abbreviazione di configurazione elettronica
Detto questo, procediamo a riempire la precedente riga di notazioni quantistiche con elettroni:
1sDue 2sDue 2 P6 3sDue 3p6 4sDue 3d10 4p6 5sDue 4d10 5 p6 6sDue 4f14 5 D10 6p6 7sDue 5f14 6d10 7p6
Quanti elettroni ci sono in tutto? 118. E a quale elemento corrisponde un numero così elevato di elettroni nel suo atomo? Al gas nobile oganeson, Og.
Supponiamo che ci sia un elemento con un numero quantico Z uguale a 119. Allora la sua configurazione elettronica di valenza sarebbe 8s1; ma quale sarebbe la sua configurazione elettronica completa?
1sDue 2sDue 2 P6 3sDue 3p6 4sDue 3d10 4p6 5sDue 4d10 5 p6 6sDue 4f14 5 D10 6p6 7sDue 5f14 6d10 7p6 8s1
E quale sarebbe la configurazione del tuo kernel elettronico, quella compatta? È:
[Og] 8s1
Notare l'ovvia semplificazione o abbreviazione. Nel simbolo [Og] sono contati tutti i 118 elettroni scritti sopra, quindi questo elemento incerto ha 119 elettroni, di cui solo uno è di valenza (sarebbe situato sotto il francio nella tavola periodica).
Esempi
generale
Supponiamo ora di voler rendere progressivamente l'abbreviazione:
[He] 2sDue 2 P6 3sDue 3p6 4sDue 3d10 4p6 5sDue 4d10 5 p6 6sDue 4f14 5 D10 6p6 7sDue 5f14 6d10 7p6
Nota che 1sDue è stato sostituito da [He]. Il prossimo gas nobile è il neon, che ha 10 elettroni. Sapendo questo, l'abbreviazione continua:
[Ne] 3sDue 3p6 4sDue 3d10 4p6 5sDue 4d10 5 p6 6sDue 4f14 5 D10 6p6 7sDue 5f14 6d10 7p6
Quindi segue l'argon, con 18 elettroni:
[Ar] 4sDue 3d10 4p6 5sDue 4d10 5 p6 6sDue 4f14 5 D10 6p6 7sDue 5f14 6d10 7p6
Poiché il prossimo gas nobile è il krypton, l'abbreviazione è anticipata da altri 36 elettroni:
[Kr] 5sDue 4d10 5 p6 6sDue 4f14 5 D10 6p6 7sDue 5f14 6d10 7p6
Lo xeno ha 54 elettroni, quindi spostiamo l'abbreviazione sull'orbitale 5p:
[Xe] 6sDue 4f14 5 D10 6p6 7sDue 5f14 6d10 7p6
A questo punto avrai notato che la configurazione elettronica è sempre abbreviata in orbitale np; cioè, i gas nobili hanno questi orbitali pieni di elettroni. E infine segue il radon, con 86 elettroni, quindi abbreviamo l'orbitale 6p:
[Rn] 7sDue 5f14 6d10 7p6
Ossigeno
L'ossigeno ha otto elettroni, la sua configurazione elettronica completa è:
1sDue2sDue2 P4
L'unica abbreviazione che possiamo usare è [He] per 1sDue. Pertanto, la configurazione del kernel elettronico diventa:
[He] 2sDue2 P4
Potassio
Il potassio ha diciannove elettroni, la sua configurazione elettronica completa è:
1sDue 2sDue 2 P6 3sDue 3p6 4s1
Notare che possiamo usare il simbolo [He] per abbreviare questa configurazione; così come [Ne] e [Ar]. Quest'ultimo è quello utilizzato perché l'argon è il gas nobile che più si avvicina al potassio. Quindi la configurazione elettronica del tuo kernel ha il seguente aspetto:
[Ar] 4s1
indiano
L'indio ha quarantanove elettroni, la sua configurazione elettronica completa è:
1sDue 2sDue 2 P6 3sDue 3p6 4sDue 3d10 4p6 5sDue 4d10 5 p1
Poiché il krypton è il gas nobile più vicino che precede l'indio, il simbolo [Kr] è usato per l'abbreviazione e abbiamo la sua configurazione elettronica del kernel:
[Kr] 5sDue 4d10 5 p1
Sebbene gli orbitali 4d non appartengano formalmente al kernel di indio, i loro elettroni non sono coinvolti (almeno in condizioni normali) nel suo legame metallico, ma piuttosto quelli degli orbitali 5s e 5p..
Tungsteno
Il tungsteno (o wolfram) ha 74 elettroni e la sua configurazione elettronica completa è:
1sDue 2sDue 2 P6 3sDue 3p6 4sDue 3d10 4p6 5sDue 4d10 5 p6 6sDue 4f14 5 D4
Ancora una volta, cerchiamo il gas nobile più vicino che lo precede. Nel tuo caso, corrisponde allo xeno, che ha i suoi orbitali 5p pieni. Quindi sostituiamo la stringa di notazioni quantistiche con il simbolo [Xe] e avremo finalmente la sua configurazione elettronica del kernel:
[Xe] 6sDue 4f14 5 D4
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Pat Thayer. (2016). Diagrammi di configurazione elettronica. Estratto da: chemistryapp.org
- Helmenstine, Anne Marie, Ph.D. (5 dicembre 2018). Definizione di nucleo di gas nobile. Estratto da: thoughtco.com/
- Wikipedia. (2019). Configurazione elettronica. Estratto da: es.wikipedia.org



Nessun utente ha ancora commentato questo articolo.