
Struttura, proprietà, rischi e usi dell'alcol butilico terziario
Il alcool butilico terziario è un composto organico la cui formula è (CH3)3COH o t-BuOH. È l'alcol terziario più semplice di tutti. A seconda della temperatura ambiente, appare come un solido o liquido incolore. L'immagine sotto mostra, ad esempio, i suoi cristalli incolori.
Questo alcol non è un substrato per l'enzima deidrogenasi alcolica, né per l'attività perossidasica della catalasi, pertanto è classificato come un alcol non metabolizzabile. A causa delle sue proprietà biochimiche, si ritiene che possa essere utile nella rilevazione dei radicali idrossilici in vivo in cellule intatte..

È uno dei quattro isomeri dell'alcool isobutilico, essendo l'isomero il meno suscettibile all'ossidazione e il meno reattivo. In natura si trova nei ceci e nella manioca o nella manioca, una radice che viene fermentata per produrre bevande alcoliche..
L'alcol butilico terziario è molto solubile in acqua e solventi organici. Il suo utilizzo principale è come solvente, svolgendo tale ruolo nella produzione di materie plastiche, profumi, sverniciatori, ecc..
Come molti composti organici, è un po 'tossico, ma a dosi elevate ha un effetto narcotico, caratterizzato da mal di testa, vertigini, vertigini, vertigini e stordimento..
Indice articolo
- 1 Struttura dell'alcool terz-butilico
- 2 Proprietà
- 2.1 Nomi chimici
- 2.2 Formula molecolare
- 2.3 Peso molecolare
- 2.4 Descrizione fisica
- 2.5 Odore
- 2.6 Punto di ebollizione
- 2.7 Punto di fusione
- 2.8 Punto di infiammabilità
- 2.9 Solubilità in acqua
- 2.10 Solubilità in solventi organici
- 2.11 Densità
- 2.12 Densità del vapore
- 2.13 Pressione di vapore
- 2.14 Coefficiente di ripartizione ottanolo / acqua
- 2.15 Termostabilità
- 2.16 Temperatura di autoaccensione
- 2.17 Decomposizione
- 2.18 Calore di vaporizzazione
- 2.19 Capacità calorica
- 2.20 Entalpia di formazione
- 2.21 Temperatura di conservazione
- 2.22 Stabilità
- 2.23 Potenziale di ionizzazione
- 2.24 Soglia di odore
- 2.25 Indice di rifrazione
- 2.26 Costante di dissociazione
- 2.27 Massima concentrazione di vapore
- 2.28 Reazioni
- 3 Rischi
- 4 Usi
- 5 Riferimenti
Struttura dell'alcool terz-butilico
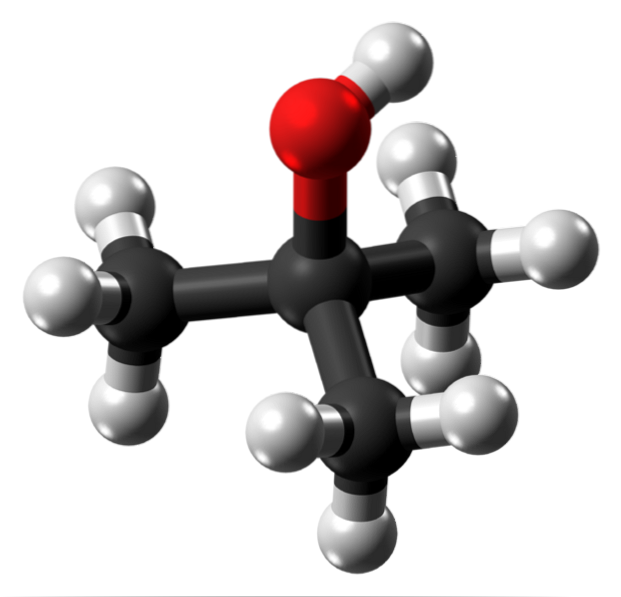
L'immagine in alto mostra la struttura molecolare dell'alcool tert-butilico con un modello di sfere e barrette. L'intera molecola ha una geometria tetraedrica globale, con il 3 ° carbonio situato al centro e i gruppi CH3 e OH ai suoi vertici.
Osservando questa struttura si capisce perché questo alcol sia terziario: il carbonio al centro è legato ad altri tre atomi di carbonio. Continuando con il tetraedro, la parte inferiore di esso può essere considerata apolare, mentre il suo vertice superiore, polare.
A questo vertice si trova il gruppo OH, che crea un momento di dipolo permanente e consente anche alle molecole t-BuOH di interagire attraverso legami idrogeno; allo stesso modo delle molecole d'acqua e di altre sostanze polari.
Nei cristalli di t-BuOH questi legami idrogeno sono un fattore chiave per la coesione delle molecole; anche se non ci sono molte informazioni su quale sia la struttura cristallina di questo alcol.
Poiché il gruppo OH è così vicino e circondato dai gruppi apolari CH3, le molecole d'acqua riescono a idratare quasi tutto l'alcol mentre interagiscono con l'OH. Questo spiegherebbe la sua grande solubilità in acqua..
Proprietà
Nomi chimici
-Alcool butilico terziario
-terz-butanolo
-2- metil-2-propanolo
-2-metilpropan-2-olo.
Formula molecolare
C4H10O o (CH3)3COH.
Peso molecolare
74,123 g / mol.
Descrizione fisica
Solido incolore o liquido incolore, a seconda della temperatura ambiente, poiché il punto di fusione è 25,4 ° C (77,9ºF). Sopra 77,9ºF è un liquido.
Odore
Simile alla canfora.
Punto di ebollizione
82,4 ºC.
Punto di fusione
77,9 ºF (25,4 ºC).
punto di accensione
11 ° C (52 ° F). Coppa chiusa.
Solubilità dell'acqua
Molto solubile. Infatti, indipendentemente dalle proporzioni, questo alcol è sempre miscibile con l'acqua..
Solubilità in solventi organici
Miscibile con etanolo, etere etilico e solubile in cloroformio.
Densità
0,78 g / cm3.
Densità del vapore
2,55 (relativo all'aria = 1).
Pressione del vapore
4,1 kPa a 20 ºC.
Coefficiente di ripartizione ottanolo / acqua
Log P = 0,35.
Termostabilità
Instabile al caldo
Temperatura di autoaccensione
896 ºF (470 ºC).
Decomposizione
Quando riscaldato, può rilasciare monossido di carbonio e vapori di isobutilene.
Calore di vaporizzazione
39,07 kJ / mol.
Capacità calorica
215.37 JK-1Talpa-1.
Entalpia di formazione
-Da 360,04 a -358,36 kJmol-1.
Temperatura di conservazione
2-8 ºC.
Stabilità
È stabile, ma incompatibile con forti agenti ossidanti, rame, leghe di rame, metalli alcalini e alluminio.
Potenziale di ionizzazione
9.70 eV.
Soglia di odore
219 mg / m3 (odore basso).
Indice di rifrazione
1.382 a 25 ºC.
Costante di dissociazione
pKa = 19,20.
Massima concentrazione di vapore
5,53% a 25 ºC.
Reazioni
-È deprotonato da una base forte per dare origine ad un anione alcossido; in particolare, un terbutossido, (CH3)3CO-.
-L'alcol butilico terziario reagisce con acido cloridrico per formare cloruro butilico terziario..
(CH3)3COH + HCl => (CH3)3CCl + HDueO
Gli alcoli terziari hanno una maggiore reattività con gli alogenuri di idrogeno rispetto agli alcoli secondari e primari.
Rischi
L'alcol ter-butilico a contatto con la pelle provoca lesioni minori, come eritema non grave e iperemia. Inoltre, non passa attraverso la pelle. Al contrario, negli occhi produce una grave irritazione.
Quando inalato, irrita il naso, la gola e i bronchi. In caso di esposizione elevata, possono verificarsi effetti narcotici, stato di sonnolenza, vertigini, vertigini e mal di testa.
Questo alcol è un agente teratogeno sperimentale, motivo per cui è stato osservato negli animali che può influenzare la comparsa di disturbi congeniti.
Per quanto riguarda lo stoccaggio, i suoi liquidi e vapori sono infiammabili, e quindi in determinate circostanze può generare incendi ed esplosioni..
L'OSHA ha stabilito un limite di concentrazione di 100 ppm (300 mg / m3) per un turno di 8 ore.
Applicazioni
-L'alcol ter-butilico viene utilizzato per l'incorporazione del gruppo terz-butilico in composti organici, al fine di preparare resine solubili in olio, e trinitro-terz-butiltoluene, un muschio artificiale. Inoltre, costituisce un materiale di partenza per la preparazione dei perossidi.
-È stato approvato dalla FDA come agente antischiuma per l'uso su materiali plastici e componenti che vengono a contatto con gli alimenti. È stato utilizzato nella produzione di essenze di frutta, plastiche e lacche.
-È un intermedio per la produzione di cloruro di terz-butile e tributilfenolo. Agisce come agente denaturante per l'etanolo.
-Viene utilizzato per la produzione di agenti di galleggiamento, come solvente organico per rimuovere le vernici e per sciogliere le essenze utilizzate nei profumi..
-È usato come potenziatore di ottano nella benzina; carburante e additivo per carburante; solvente da utilizzare nella pulizia e come sgrassante.
-L'alcool tert-butilico è un agente intermedio nella produzione dell'etere terz-butilmetilico (MTBE) e dell'etere tributiletilico (ETBE), reagendo rispettivamente con metanolo ed etanolo.
-Agisce allo stesso modo anche nella produzione di tributil idroperossido (TBHP) per reazione con il perossido di idrogeno..
-È usato come reagente nel processo noto come riarrangiamento di Curtius..
Riferimenti
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10th edizione.). Wiley plus.
- Wikipedia. (2019). Alcool terz-butilico. Estratto da: en.wikipedia.org
- CommonOrganicChemistry. (s.f.). t-butanolo. Estratto da: commonorganicchemistry.com
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Butanolo terziario. Database PubChem. Estratto da: pubchem.ncbi.nlm.nih.gov
- Carey F. A. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.



Nessun utente ha ancora commentato questo articolo.