
Formula, effetti, usi e rischi del cloro gassoso
Il cloro gassoso (dicloro, cloro biatomico, cloro molecolare o semplicemente cloro) è un gas giallo-verdastro, dall'odore pungente e soffocante, non combustibile a temperatura ambiente e pressione atmosferica.
È l'elemento con la più alta affinità elettronica e la terza più alta elettronegatività, dietro solo all'ossigeno e al fluoro. È estremamente reattivo e un forte agente ossidante.
L'elevato potenziale ossidante del cloro elementare ha portato allo sviluppo di candeggine e disinfettanti commerciali, nonché di un reagente per molti processi nell'industria chimica..
Sotto forma di ioni cloruro, il cloro è necessario per tutte le specie di vita conosciute. Ma il cloro elementare in alte concentrazioni è estremamente pericoloso e velenoso per tutti gli organismi viventi, motivo per cui è stato utilizzato nella prima guerra mondiale come primo agente di guerra chimica gassosa..

È tossico per inalazione. L'inalazione a lungo termine di basse concentrazioni o l'inalazione a breve termine di alte concentrazioni di gas di cloro hanno effetti nocivi sulla salute..
I vapori sono molto più pesanti dell'aria e tendono a depositarsi nelle zone basse. Non brucia, ma supporta la combustione. È leggermente solubile in acqua. Il contatto con liquidi non confinati può causare congelamento da raffreddamento evaporativo.
Utilizzato per purificare l'acqua, candeggiare la pasta di legno e produrre altri prodotti chimici.
Indice articolo
- 1 Formula
- 2 struttura 2D
- 3 caratteristiche
- 3.1 Proprietà fisiche e chimiche
- 3.2 Avvisi di reattività
- 3.3 Infiammabilità
- 3.4 Reattività
- 3.5 Tossicità
- 4 Usi
- 5 Effetti clinici
- 6 Sicurezza e rischi
- 6.1 Classi di pericolo GHS
- 6.2 Codici dei consigli di prudenza
- 7 Riferimenti
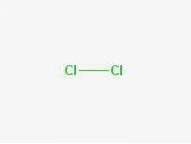
Formula
Formula: Cl-Cl
numero CAS: 7782-50-5
Struttura 2D

Caratteristiche
Proprietà fisiche e chimiche

Il cloro gassoso appartiene al gruppo reattivo dei forti agenti ossidanti. Questi composti spesso reagiscono vigorosamente con altri composti..
Il cloro gassoso appartiene anche al gruppo reattivo dei forti agenti alogenanti, che trasferiscono uno o più atomi di alogeno al composto con cui stanno reagendo..
Gli agenti alogenanti sono generalmente acidi e quindi reagiscono, in alcuni casi violentemente, con le basi.
Molti di questi composti sono reattivi all'acqua e reattivi all'aria. Gli alogeni sono altamente elettronegativi e forti ossidanti.
Avvisi di reattività
Il cloro gassoso è un forte agente ossidante. Reagisce con l'acqua. L'acqua dissolve il cloro gassoso, formando una miscela di acido cloridrico e acidi ipoclorosi.
Infiammabilità
Può incendiare altri materiali combustibili (legno, carta, olio, ecc.). La miscelazione con i combustibili può provocare un'esplosione. Il contenitore può esplodere a contatto con il fuoco. Esiste il rischio di esplosione (e avvelenamento) dall'accumulo dei suoi vapori all'interno, nelle fognature o all'esterno..
Le miscele di idrogeno e cloro (5-95%) possono esplodere per l'azione di quasi ogni forma di energia (calore, luce solare, scintille, ecc.).
Emette fumi altamente tossici se riscaldato. Quando combinato con acqua o vapore produce vapori di acido cloridrico tossici e corrosivi.
Reattività
Il cloro reagisce in modo esplosivo con (o favorisce la combustione di) molti materiali comuni.
- Il cloro accende l'acciaio a 100 ° C in presenza di fuliggine, ossido, carbonio o altri catalizzatori.
- Accendere la lana d'acciaio asciutta a 50 ° C.
- Accendi i solfuri a temperatura ambiente.
- Accende (nella sua forma liquida) la gomma naturale e sintetica.
- Accende i trialchilborani e il biossido di tungsteno.
- Si infiamma a contatto con idrazina, idrossilammina e nitruro di calcio.
- Si accende o esplode con arsina, fosfina, silano, diborano, stibina, fosforo rosso, fosforo bianco, boro, carbone attivo, silicio, arsenico.
- Provoca l'accensione e una leggera esplosione quando gorgoglia nel metanolo freddo.
- Esplode o prende fuoco se mescolato eccessivamente con ammoniaca e riscaldato.
- Forma tricloruro di azoto esplosivo a contatto con il reagente Biureto contaminato con acido cianurico.
- Forma facilmente derivati esplosivi di N-cloro con aziridina.
Il cloro (nella sua forma liquida o gassosa) reagisce con:
- Alcoli (esplosione)
- Alluminio fuso (esplosione)
- Silani (esplosione)
- Pentafluoruro di bromo
- Disolfuro di carbonio (esplosione catalizzata dal ferro)
- Cloro-2-propino (il cloro in eccesso provoca un'esplosione)
- Ftalato di dibutile (esplosione a 118 ° C)
- Etere dietilico (acceso)
- Zinco dietilico (lit)
- Glicerolo (esplosione a 70-80 ° C)
- Metano su ossido di mercurio giallo (esplosione)
- Acetilene (esplosione provocata dalla luce solare o dal riscaldamento)
- Etilene su mercurio, ossido di mercurio (I) o ossido di argento (I) (esplosione causata da calore o luce)
- Benzina (reazione esotermica e quindi detonazione)
- Miscela nafta-idrossido di sodio (esplosione violenta)
- Cloruro di zinco (reazione esotermica)
- Cera (esplosione)
- Idrogeno (esplosione avviata dalla luce)
- Carburo di ferro
- Uranio e zirconio
- Idruri di sodio, potassio e rame
- Lattina
- Polvere di alluminio
- Vanadio in polvere
- Foglio di alluminio
- Orpello
- Lamina di rame
- Calcio in polvere
- Fil di ferro
- Manganese in polvere
- Potassio
- Polvere di antimonio
- Bismuto
- Germanio
- Magnesio
- Sodio
- Zinco
Tossicità
Il cloro gassoso è velenoso e può essere fatale se inalato. Il contatto può causare ustioni alla pelle e agli occhi, nonché bronchite o malattie polmonari croniche..

Applicazioni
Oggi vengono utilizzati in commercio circa 15.000 composti di cloro. Il cloruro di sodio è di gran lunga il composto di cloro più comune ed è la principale fonte di cloro e acido cloridrico per l'enorme industria chimica del cloro..
Di tutto il cloro elementare prodotto, circa il 63% viene utilizzato nella fabbricazione di composti organici, il 18% nella fabbricazione di composti inorganici di cloro e il restante 19% del cloro prodotto viene utilizzato per candeggine e prodotti per la disinfezione..

Tra i composti organici più significativi in termini di volume di produzione ci sono 1,2-dicloroetano e cloruro di vinile (prodotti intermedi nella produzione di PVC), cloruro di metile, cloruro di metilene, cloroformio, cloruro di vinilidene, tra gli altri.
I principali composti inorganici includono HCl, Cl2O, HOCl, NaClO3, AlCl3, SiCl4, SnCl4, PCl3, PCl5, POCl3, AsCl3, SbCl3, SbCl5, BiCl3, S2Cl2, SCl2, SOCI2, ClF3, ICl, ICl3, MoCl3, TiCl4, FeCl3 , ZnCl2 e molti altri.
Il cloro gassoso viene utilizzato nelle operazioni di sbiancamento industriale, nel trattamento delle acque reflue, nella produzione di pastiglie per la clorazione delle piscine o nella guerra chimica.
Il cloro gassoso (noto come bertholite), fu usato per la prima volta come arma nella prima guerra mondiale dalla Germania.
Dopo il suo primo utilizzo, entrambe le parti nel conflitto usarono il cloro come arma chimica, ma fu presto sostituito da fosgene e gas mostarda, che sono più mortali..
Il cloro gassoso è stato utilizzato anche durante la guerra in Iraq nella provincia di Anbar nel 2007.
Effetti clinici
Il cloro gassoso è una delle più comuni esposizioni a sostanze irritanti per inalazione singola professionale e ambientale. Studi recenti hanno riportato che la miscela di candeggina (candeggina, realizzata principalmente a base di ipoclorito di sodio) con altri prodotti per la pulizia, è la causa più frequente (21% dei casi) di esposizione per singola inalazione segnalata nei centri antiveleni. Dagli Stati Uniti.
I principali effetti tossici sono dovuti al danno tissutale locale piuttosto che all'assorbimento sistemico. Si ritiene che il danno cellulare derivi dall'ossidazione di gruppi funzionali sui componenti cellulari; alle reazioni con l'acqua nei tessuti per formare acido ipocloroso e acido cloridrico; e la generazione di radicali liberi dell'ossigeno (sebbene questa idea sia ora controversa).
Nell'intossicazione da lieve a moderata ci sono: tosse, mancanza di respiro, dolore toracico, sensazione di bruciore alla gola e nell'area retrosternale, nausea o vomito, irritazione oculare e nasale, soffocamento, debolezza muscolare, vertigini, fastidio addominale e mal di testa.
In caso di avvelenamento grave, vi sono: edema delle vie aeree superiori, laringospasmo, edema polmonare grave, polmonite, ipossiemia persistente, insufficienza respiratoria, danno polmonare acuto e acidosi metabolica.
L'esposizione cronica al cloro gassoso è una delle cause più comuni di asma professionale. Può causare dispnea, palpitazioni, dolore toracico, sindrome da disfunzione reattiva delle vie aeree superiori, erosione dello smalto dei denti e aumento della prevalenza di sindromi virali. L'esposizione cronica a 15 ppm provoca tosse, emottisi, dolore toracico e mal di gola.
L'esposizione cutanea può causare eritema cutaneo, dolore, irritazione e ustioni. Una forte esposizione può causare collasso cardiovascolare e arresto respiratorio. Ad alte concentrazioni possono verificarsi sincope e morte quasi immediata. Il cloro (come ipoclorito) è teratogeno negli animali da esperimento.
Sicurezza e rischi
Indicazioni di pericolo del Sistema mondiale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS).
Il sistema globale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS) è un sistema concordato a livello internazionale, creato dalle Nazioni Unite progettato per sostituire i vari standard di classificazione ed etichettatura utilizzati in diversi paesi utilizzando criteri coerenti a livello globale (Nations United, 2015 ).
Le classi di pericolo (e il corrispondente capitolo GHS), gli standard di classificazione ed etichettatura e le raccomandazioni per il cloro gassoso sono i seguenti (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):
Classi di pericolo GHS
H270: Può provocare o aggravare un incendio; Ossidante [Gas ossidanti pericolo - Categoria 1]
H280: Contiene gas sotto pressione; Può esplodere se riscaldato [gas di avvertimento sotto pressione - gas compresso, gas liquefatto, gas disciolto]
H315: Provoca irritazione cutanea [Attenzione Corrosione / irritazione cutanea - Categoria 2]
H319: Provoca grave irritazione oculare [Attenzione Lesioni oculari gravi / irritazione oculare - Categoria 2A]
H330: Letale per inalazione [Pericolo Tossicità acuta, inalazione - Categoria 1, 2]
H331: Tossico per inalazione [Pericolo Tossicità acuta, inalazione - Categoria 3]
H335: Può irritare le vie respiratorie [Attenzione Tossicità specifica per organi bersaglio, esposizione singola; Irritazione delle vie respiratorie - Categoria 3]
H400: Molto tossico per gli organismi acquatici [Attenzione Pericoloso per l'ambiente acquatico, pericolo acuto - Categoria 1]
H410: Altamente tossico per gli organismi acquatici con effetti di lunga durata [Attenzione Pericoloso per l'ambiente acquatico, pericolo a lungo termine - Categoria 1]
(PubChem, 2017)
Codici dei consigli di prudenza
P220, P244, P260, P261, P264, P271, P273, P280, P284, P302 + P352, P304 + P340, P305 + P351 + P338, P310, P311, P312, P320, P321, P332 + P313, P337 + P313, P362, P370 + P376, P391, P403, P403 + P233, P405, P410 + P403 e P501.
Riferimenti
- Benjah-bmm27 (2007). Dichlorine-gas-3D-vdW [immagine]. Estratto da: commons.wikimedia.org.
- Bundesarchiv (1915). Deutsche Soldaten versprühen künstlichen Nebel [immagine]. Estratto da: commons.wikimedia.org.
- ChemIDplus (2017) Struttura 3D di 7782-50-5 - Cloro [immagine] Estratto da: chem.nlm.nih.gov.
- Amministrazione nazionale oceanica e atmosferica (NOAA). CAMEO Chemicals. (2017). Scheda tecnica Reactive Group. Agenti ossidanti, forti. Silver Spring, MD. UNIONE EUROPEA; Estratto da: cameochemicals.noaa.gov.
- Oelen, W., (2005). Cloro gassoso in una bottiglia [immagine]. Estratto da: commons.wikimedia.org.
- Sargent, J., (1918). Gasato [immagine]. Estratto da: en.wikipedia.org.
- Tomia (2006). Plastic-recyc-03 [immagine]. Estratto da: commons.wikimedia.org.
- Wikipedia (2017). Cloro. Estratto da: en.wikipedia.org.



Nessun utente ha ancora commentato questo articolo.