
Caratteristiche, usi dell'acido manganico o permanganico
Il acido manganico o permanganico è un acido bibasico con la formula H2MnO4, formato da manganese, analogo all'acido solforico. Si trova solo in soluzione e nei sali di manganato.
- Nome sistematico: Diidrogeno (tetraossidomanganato).
- Tipo composto: Oxoacids (combinazioni ternarie formate da idrogeno, un elemento non metallico e ossigeno).
- Formula molecolare: H2MnO4
- Massa molecolare: 120.9515

Esempi di reazioni
MnO3 + H2O = H2MnO4
KMnO4 + H2O2 = KO2 + H2MnO4
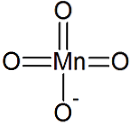
Caratteristiche
Le soluzioni di acido permanganico (fino al 20%) sono liquidi viola, con un odore di ozono. L'idrato di cristallo (HMnO4 · 2H2O) è un solido cristallino viola che si decompone sopra i 20 gradi Celsius.
L'acido permanganico è un ossidante molto forte, sebbene più delicato della sua anidride. Si decompone spontaneamente, inghiottendo l'ossigeno e precipitando il biossido di manganese, che catalizza l'ulteriore decomposizione acida.
Raffreddando la soluzione acida concentrata instabile vicino al punto di congelamento, è possibile preparare l'idrato cristallino. Le fonti variano a seconda della natura di questo composto: secondo alcune fonti è un sale di idronio dell'acido permanganico, secondo altre è un complesso di acido polimanganico.
Soluzioni eccessivamente concentrate di questo acido possono decomporsi spontaneamente con l'evoluzione dell'ozono. Ciò consente di preparare chimicamente l'ozono facendo reagire il permanganato di potassio con acido solforico di media concentrazione (50-80%)..
Questa reazione produce una soluzione eccessivamente concentrata di acido permanganico, che si decompone rapidamente rilasciando ozono..
L'acido solforico con una concentrazione superiore all'80% non deve essere utilizzato per questa reazione poiché ciò può portare alla formazione di anidride (epossido di manganese), che è estremamente pericolosa..
Preparazione
L'acido permanganico può essere preparato sciogliendo l'epossido di manganese in acqua o facendo reagire il permanganato di bario con acido solforico. Una soluzione impura può anche essere preparata sciogliendo permanganato di potassio in acido solforico a media concentrazione (50-80%)..
Guida
Non si sa molto sui pericoli dell'acido permanganico, ma deve essere trattato con cautela poiché è un acido forte e un ossidante molto forte. Inoltre, può rilasciare ozono, che è tossico.
Conservazione
Non è pratico conservare questo acido a causa della sua instabilità. Dovrebbe essere usato non appena è finito. L'idrato può essere conservato finché è congelato (al di sotto del punto di congelamento dell'acqua).
Fornitura
L'acido permanganico può essere scaricato nel terreno, poiché provoca la decomposizione del composto, ossidando il terreno e trasformandosi in biossido di manganese, che è sicuro e insolubile..
Permanganati
Il gruppo anionico univalente MnO4 derivato dall'acido permanganico è tutti forti agenti ossidanti. Sono sali che contengono l'anione MnO4-, normalmente di colore rosso violaceo intenso e con spiccate proprietà ossidanti..
1- Permanganato di potassio
Formula molecolare: KMnO4
Peso molecolare: 158,032 g / mol
È il più noto di tutti i permanganati. Conosciuto anche come cristalli Condy, è un composto altamente ossidante, inodore, solubile in acqua e in molti solventi organici, ha cristalli viola e un sapore dolce. (Definizione dal dizionario di McGraw-Hill di informazioni scientifiche e tecniche, 4a ed).
Il permanganato di potassio non è combustibile ma accelera l'accensione del materiale combustibile. Se il materiale combustibile è finemente suddiviso, la miscela può essere esplosiva. A contatto con materiali combustibili liquidi può provocare l'accensione spontanea. A contatto con l'acido solforico, può provocare incendi o esplosioni. Utilizzato per produrre altri prodotti chimici e come disinfettante.
Farmacologia e biochimica
Classificazione farmacologica: MeSH
Indicatori e reagenti
Sono sostanze utilizzate per il rilevamento, l'identificazione e l'analisi di processi o condizioni chimiche, biologiche o patologiche..
Gli indicatori sono sostanze che cambiano nell'aspetto fisico, ad esempio il colore, quando si avvicinano al punto in cui passa tra acidità e alcalinità. I reagenti sono sostanze utilizzate per il rilevamento o la determinazione di un'altra sostanza con mezzi chimici o microscopici, in particolare l'analisi.
I tipi di reagenti sono precipitanti, solventi, ossidanti, riducenti, flussi e reagenti colorimetrici. (Hackh's Chemical Dictionary, 5a edizione, pag.301, pag.499).
Uso industriale
Come agenti sbiancanti, agenti odori e agenti ossidanti / riducenti.
Metodi di produzione
Possono essere preparati ossidando biossido di manganese con clorato di potassio in soluzione di idrossido di potassio, quindi completando l'ossidazione con cloro o aria e anidride carbonica..
Sicurezza e rischi
-Può intensificare il fuoco.
-Nocivo se ingerito.
- Provoca gravi ustioni cutanee.
- Può provocare lesioni agli occhi.
-Può causare irritazione alle vie respiratorie.
- Sospettato di provocare alterazioni genetiche.
- Si sospetta che possa danneggiare la fertilità e il feto.
- Provoca danni agli organi in caso di esposizione prolungata o ripetuta.
- È molto tossico per gli organismi acquatici, con effetti di lunga durata..
Dannoso per la salute
Può provocare ustioni e macchie della pelle marrone scuro. Se ingerito, colpisce gravemente il sistema gastrointestinale. Può essere fatale se consumato più di 4 once.
Pericolo di incendio
Non è combustibile ma aumenta la combustione di altre sostanze. Provoca gas o vapori irritanti o tossici in caso di incendio.
Comportamento in caso di incendio: Può provocare un incendio a contatto con combustibili provocando l'esplosione dei contenitori. Può causare grande rischio di incendio ed esplosione a contatto con sostanze combustibili o agenti riducenti.
Rischi chimici
Si decompone se riscaldato e questo produce gas tossici e fumi irritanti. La sostanza è un forte ossidante. Reagisce con materiali combustibili e riducenti che genera pericolo di incendio e esplosione. Reagisce violentemente con i metalli in polvere, creando pericolo di incendio.
Pronto soccorso se entri in contatto con il permanganato di potassio
Se ingerito, indurre il vomito e proseguire con una lavanda gastrica completa.
Se inalato, sono necessari aria fresca e riposo. Potrebbe essere necessaria la respirazione artificiale. È necessario consultare un medico.
Se viene a contatto con la pelle, sciacquare con abbondante acqua per almeno 15 minuti, quindi rimuovere gli indumenti contaminati e risciacquare nuovamente. È anche importante consultare un medico.
In caso di contatto con gli occhi, sciacquare abbondantemente con acqua per diversi minuti. Rivolgiti al medico.
2- Permanganato di sodio
Formula molecolare: MnNaO4
Peso molecolare: 141,924 g / mol
Il permanganato di sodio è un solido cristallino viola. Non combustibile ma accelera la combustione di materiale combustibile. Può infiammarsi spontaneamente a contatto con materiali combustibili liquidi. Il contatto con l'acido solforico può provocare incendi o esplosioni. Usato in medicina, come disinfettante e per molti altri usi.
Uso e produzione
È utilizzato nell'industria come agente ossidante e riducente. Viene utilizzato anche per il trattamento delle acque, per sbiancare i tessuti
Metodi di produzione
Il manganato di sodio viene sciolto in acqua e viene introdotto cloro o ozono. La soluzione è concentrata e cristallizzata.
3- Permanganato di calcio
Formula molecolare: CaMn2O8
Peso molecolare: 277,946 g / mol
Caratteristiche
Il permanganato di calcio è un solido cristallino viola. È usato come disinfettante e deodorante, nella purificazione dell'acqua e per molti altri usi.
Uso medico
Lo ione manganico risultante da questo permanganato è astringente e aiuta a sopprimere l'infiammazione.



Nessun utente ha ancora commentato questo articolo.