
Struttura, proprietà, usi, sintesi dell'acido ipocloroso (HClO)

Il Acido ipocloroso È un composto inorganico la cui formula chimica è HClO. Corrisponde al meno ossidato degli ossoacidi del cloro, poiché contiene un solo atomo di ossigeno. Da esso derivano l'anione ipoclorito, ClO-, e i suoi sali, ampiamente usati come disinfettanti commerciali per l'acqua.
HClO è il più forte agente ossidante e antimicrobico generato quando il cloro gassoso si dissolve in acqua. La sua azione antisettica è nota da più di un secolo, anche prima che le soluzioni di cloro fossero utilizzate per pulire le ferite dei soldati nella prima guerra mondiale..
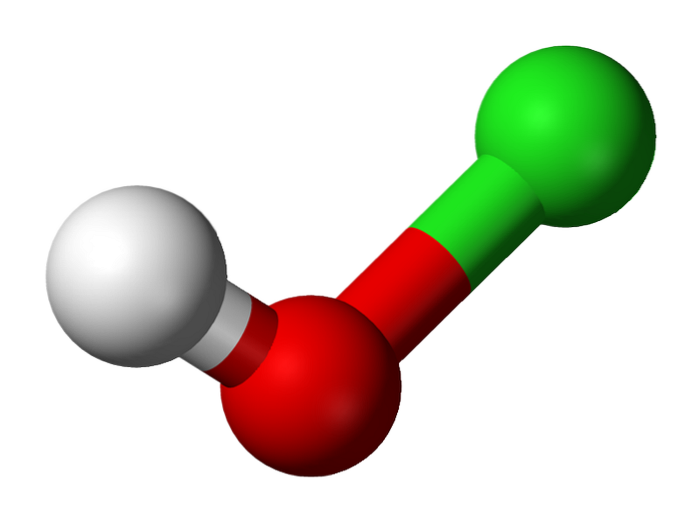
La sua scoperta risale infatti all'anno 1834, ad opera del chimico francese Antoine Jérôme Balard, che ottenne la parziale ossidazione del cloro facendolo gorgogliare in una sospensione acquosa di ossido di mercurio, HgO. Da allora, è stato utilizzato come disinfettante e agente antivirale..
Chimicamente parlando, l'HClO è un agente ossidante che finisce per cedere il suo atomo di cloro ad altre molecole; In altre parole, i composti clorurati possono essere sintetizzati con esso, con le cloroammine di grande rilevanza nello sviluppo di nuovi antibiotici..
Negli anni '70 si scoprì che l'organismo è in grado di produrre naturalmente questo acido attraverso l'azione dell'enzima mieloperossidasi; enzima che agisce sui perossidi e sugli anioni cloruro durante la fagocitosi. Quindi, dallo stesso organismo può emergere questo "killer" di intrusi, ma su scala innocua per il proprio benessere..
Indice articolo
- 1 Struttura
- 2 Proprietà
- 2.1 Acidità
- 2.2 Agente ossidante
- 2.3 Stabilità
- 3 Sintesi
- 3.1 Acqua e cloro
- 3.2 Elettrolisi
- 4 Usi
- 4.1 Aspetti generali
- 4.2 Disinfezione e pulizia
- 5 Rischi
- 6 Riferimenti
Struttura
L'immagine in alto mostra la struttura di HClO. Si noti che la formula contraddice la struttura: la molecola è H-O-Cl e non H-Cl-O; tuttavia, quest'ultimo è solitamente preferito per poterlo confrontare direttamente con le sue controparti più ossidate: HClODue, HClO3 e HClO4.
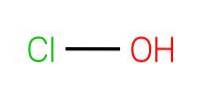
Idrogeno acido, H.+, rilasciato da HClO si trova sul gruppo OH attaccato all'atomo di cloro. Da notare anche le notevoli differenze di lunghezza nei legami O-H e Cl-O, quest'ultimo essendo il più lungo a causa del minor grado di sovrapposizione degli orbitali del cloro, più diffusi, con quelli dell'ossigeno..
La molecola HOCl difficilmente può rimanere stabile in condizioni normali; non può essere isolato dalle sue soluzioni acquose senza essere sproporzionato o rilasciato come cloro gassoso, ClDue.
Pertanto, non sono presenti cristalli anidri (neppure loro idrati) di acido ipocloroso; E ad oggi, non vi è nemmeno alcuna indicazione che possano essere preparati con metodi stravaganti. Se potessero cristallizzare, le molecole di HClO interagirebbero tra loro attraverso i loro dipoli permanenti (cariche negative orientate verso l'ossigeno).
Proprietà
Acidità
HClO è un acido monoprotico; cioè puoi donare solo uno H.+ al mezzo acquoso (che è dove si forma):
HClO (aq) + HDueO ↔ ClO-(ac) + H3O+(ac) (pKa = 7,53)
Da questa equazione di equilibrio si osserva che una diminuzione degli ioni H.3O+ (un aumento della basicità del mezzo), favorisce la formazione di più anioni ipoclorito, ClO-. Di conseguenza, se vuoi mantenere una soluzione di ClO relativamente stabile- il pH deve essere basico, che si ottiene con NaOH.
La sua costante di dissociazione, pKa, mette in dubbio che l'HClO è un acido debole. Pertanto, quando lo maneggi concentrato, non dovresti preoccuparti così tanto degli ioni H3O+, ma dallo stesso HClO (data la sua elevata reattività e non per la sua corrosività).
Agente ossidante
È stato detto che l'atomo di cloro in HClO ha un numero di ossidazione di +1. Ciò significa che difficilmente richiede il guadagno di un singolo elettrone per tornare al suo stato fondamentale (Cl0) ed essere in grado di formare la molecola ClDue. Di conseguenza, l'HClO sarà ridotto a ClDue e H.DueOppure ossidando un'altra specie più rapidamente rispetto alla stessa ClDue o ClO-:
2HClO (aq) + 2H+ + 2e- ↔ ClDue(g) + 2HDueO (l)
Questa reazione ci permette già di vedere quanto sia stabile l'HClO nelle sue soluzioni acquose..
Il suo potere ossidante non è misurato solo dalla formazione di ClDue, ma anche per la sua capacità di rinunciare al suo atomo di cloro. Ad esempio, può reagire con specie azotate (comprese ammoniaca e basi azotate), per produrre cloroammine:
HClO + N-H → N-Cl + HDueO
Nota che un legame N-H di un gruppo amminico (-NHDue) per lo più, ed è sostituito da un N-Cl. Lo stesso accade con i legami O-H dei gruppi idrossilici:
HClO + O-H → O-Cl + HDueO
Queste reazioni sono cruciali e spiegano l'azione disinfettante e antibatterica di HClO..
Stabilità
L'HClO è instabile quasi ovunque lo si guardi. Ad esempio, l'anione ipoclorito è sproporzionato nelle specie di cloro con numeri di ossidazione di -1 e +5, più stabile di +1 in HClO (H+Cl+ODue-):
3ClO-(aq) ↔ 2Cl-(ac) + ClO3-(AC)
Questa reazione sposterebbe nuovamente l'equilibrio verso la scomparsa dell'HClO. Allo stesso modo, HClO partecipa direttamente a un equilibrio parallelo con acqua e cloro gassoso:
ClDue(g) + HDueO (l) ↔ HClO (aq) + H+(ac) + Cl-(AC)
Ecco perché provare a riscaldare una soluzione di HClO per concentrarla (o isolarla) porta alla produzione di ClDue, identificato come gas giallo. Allo stesso modo, queste soluzioni non possono essere esposte alla luce per troppo tempo, né alla presenza di ossidi metallici, in quanto si decompongono ClDue (HClO scompare ancora di più):
2ClDue + 2HDueO → 4HCl + ODue
HCl reagisce con HClO per generare più ClDue:
HClO + HCl → ClDue + HDueO
E così via fino a quando non c'è più HClO.
Sintesi
Acqua e cloro
Uno dei metodi per preparare o sintetizzare l'acido ipocloroso è già stato implicitamente spiegato: sciogliere il cloro gassoso in acqua. Un altro metodo abbastanza simile consiste nel dissolvere l'anidride di questo acido in acqua: il monossido di dicloro, ClDueO:
ClDueO (g) + HDueO (l) ↔ 2HClO (aq)
Anche in questo caso non c'è modo di isolare l'HClO puro, poiché l'evaporazione dell'acqua sposterebbe l'equilibrio alla formazione di ClDueOppure, gas che fuoriuscirebbe dall'acqua.
D'altra parte, è stato possibile preparare soluzioni più concentrate di HClO (20%) utilizzando ossido di mercurio, HgO. Per fare questo, il cloro viene sciolto in un volume d'acqua proprio al suo punto di congelamento, in modo tale da ottenere un ghiaccio clorurato. Quindi questo stesso ghiaccio viene mescolato e mentre si scioglie si mescola con l'HgO:
2ClDue + HgO + 12HDueO → 2HClO + HgClDue + 11HDueO
La soluzione al 20% di HClO può essere finalmente distillata sotto vuoto.
Elettrolisi
Un metodo più semplice e sicuro per preparare soluzioni di acido ipocloroso consiste nell'utilizzare le salamoie come materia prima al posto del cloro. Le salamoie sono ricche di anioni cloruro, Cl-, che attraverso un processo di elettrolisi può essere ossidato a ClDue:
2HDueO → ODue + 4H+ + 4e-
2Cl- ↔ 2e- + ClDue
Queste due reazioni avvengono all'anodo, dove viene prodotto il cloro, che si dissolve immediatamente dando origine a HClO; mentre nel vano catodico l'acqua si riduce:
2HDueO + 2e- → 2OH- + HDue
In questo modo, l'HClO può essere sintetizzato su scala commerciale o industriale; e queste soluzioni ottenute da salamoie sono, infatti, i prodotti disponibili in commercio di questo acido.
Applicazioni
Caratteristiche generali
HClO può essere utilizzato come agente ossidante per ossidare gli alcoli in chetoni e per sintetizzare cloroammine, cloroammidi o cloroidrine (a partire dagli alcheni).
Tuttavia, tutti i suoi altri usi possono essere racchiusi in una parola: biocida. È un killer di funghi, batteri, virus e un neutralizzatore di tossine rilasciate da agenti patogeni.
Il sistema immunitario del nostro corpo sintetizza il proprio HClO per azione dell'enzima mieloperossidasi, aiutando i globuli bianchi a debellare gli intrusi che causano l'infezione.
Innumerevoli studi suggeriscono vari meccanismi dell'azione di HClO sulla matrice biologica. Questo dona il suo atomo di cloro ai gruppi amminici di alcune proteine e ossida anche i loro gruppi SH presenti ai ponti disolfuro S-S, determinando la loro denaturazione..
Allo stesso modo, arresta la replicazione del DNA reagendo con basi azotate, influisce sulla completa ossidazione del glucosio e può anche deformare la membrana cellulare. Tutte queste azioni finiscono per provocare la morte dei germi.
Disinfezione e pulizia
Ecco perché le soluzioni HClO finiscono per essere utilizzate per:
-Trattamento di ferite infettive e cancrena
-Disinfettare le riserve d'acqua
-Agente sterilizzante per materiale chirurgico o strumenti utilizzati in medicina veterinaria, medicina e odontoiatria
-Disinfettante di qualsiasi tipo di superficie o oggetto in genere: bar, corrimano, macchine da caffè, ceramiche, tavoli in vetro, banconi da laboratorio, ecc..
-Sintetizza le cloroammine che fungono da antibiotici meno aggressivi, ma allo stesso tempo più durevoli, specifiche e stabili dello stesso HClO
Rischi
Le soluzioni di HClO possono essere pericolose se sono altamente concentrate, poiché possono reagire violentemente con le specie inclini all'ossidazione. Inoltre, tendono a rilasciare cloro gassoso quando destabilizzati, quindi devono essere conservati secondo un rigoroso protocollo di sicurezza..
HClO è talmente reattivo nei confronti dei germi che laddove viene annaffiato scompare all'istante, senza mettere in pericolo successivamente chi tocca le superfici da esso trattate. Lo stesso accade all'interno dell'organismo: si decompone rapidamente o viene neutralizzato da qualsiasi specie nell'ambiente biologico.
Quando generato dal corpo stesso, è presumibile che possa tollerare basse concentrazioni di HClO. Tuttavia, se altamente concentrato (utilizzato per scopi sintetici e non disinfettanti) può avere effetti indesiderati attaccando anche le cellule sane (della pelle, ad esempio).
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Gottardi, W., Debabov, D., & Nagl, M. (2013). N-clorammine, una promettente classe di antinfettivi topici ben tollerati. Agenti antimicrobici e chemioterapia, 57 (3), 1107-1114. doi: 10.1128 / AAC.02132-12
- Di Jeffrey Williams, Eric Rasmussen e Lori Robins. (6 ottobre 2017). Acido ipocloroso: sfruttare una risposta innata. Recupero da: infezionicontrol.tips
- Hydro Instruments. (s.f.). Chimica di base della clorazione. Estratto da: hydroinstruments.com
- Wikipedia. (2019). Acido ipocloroso. Estratto da: en.wikipedia.org
- Serhan Sakarya et al. (2014). Acido ipocloroso: un agente ideale per la cura delle ferite con una potente potenza microbicida, antibiofilm e cicatrizzante. Ferite da HMP. Estratto da: feriteresearch.com
- PrebChem. (2016). Preparazione dell'acido ipocloroso. Estratto da: prepchem.com


Nessun utente ha ancora commentato questo articolo.