
Struttura, proprietà, ottenimento, usi dell'acido gallico

Il acido gallico è un composto organico di formula molecolare C6HDue(OH)3COOH che appartiene alla categoria dei polifenoli. È riconosciuto come una polvere cristallina con un colore bianco che è vicino al giallo pallido..
È un acido triidrossibenzoico formato da un anello benzenico a cui sono attaccati un gruppo acido carbossilico (-COOH) e 3 gruppi idrossilici (-OH) situati nelle posizioni 3, 4 e 5 dell'anello..
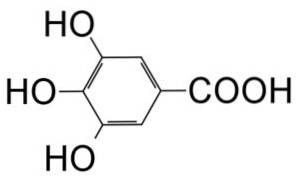
In natura è ampiamente diffuso, in quanto è un prodotto che si forma in quantità significative all'interno di piante e funghi. Esiste libero o attaccato ai tannini della maggior parte delle specie vegetali, dove spiccano noci, uva, piante divi-divi, corteccia di quercia, melograno o sue radici, piante di sommacco e tè..

Si trova anche nel miele, nel cacao, in vari frutti di bosco, nel mango e in altri tipi di frutta e verdura e in alcune bevande come il vino e gli infusi di tè..
Nei tessuti vegetali è sotto forma di estere o gallato. La quantità in cui si trova dipende da stimoli esterni, come la quantità di radiazioni UV che la pianta ha ricevuto, stress chimici e infezioni microbiche..
Nel caso dell'uva e del vino, dipende dal vitigno, dalla lavorazione e dalla conservazione. Nel tè verde il contenuto di gallati è elevato, ma il cacao contiene più del tè verde e del vino rosso.
Chimicamente si comporta come un agente riducente. È astringente e antiossidante. È stato utilizzato anche negli inchiostri da scrittura blu ed è comunemente usato nell'industria farmaceutica..
Ha un ampio potenziale nelle applicazioni mediche, poiché le molteplici proprietà dell'acido gallico e dei suoi derivati lo rendono un promettente agente terapeutico nella medicina preventiva.
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Densità
- 3.5 Solubilità
- 3.6 Costante di dissociazione
- 3.7 Proprietà chimiche
- 3.8 Altre proprietà
- 4 Ottenimento
- 5 Usi
- 5.1 - In inchiostri e coloranti
- 5.2 - Nelle applicazioni mediche
- 5.3 - In potenziali applicazioni mediche
- 5.4 - Negli usi veterinari
- 5.5 - In varie applicazioni
- 5.6 - Utilità in ambienti acquatici naturali
- 6 Riferimenti
Struttura
L'acido gallico cristallizza dal metanolo assoluto o dal cloroformio sotto forma di aghi bianchi. Cristallizza in acqua sotto forma di aghi setosi dal suo monoidrato.
Nomenclatura
- acido gallico.
- Acido 3,4,5-triidrossibenzoico.
Proprietà
Stato fisico
Aghi solidi e cristallini.
Peso molecolare
170,12 g / mol.
Punto di fusione
Si decompone a 235-240 ºC, generando pirogallolo e CODue
Densità
1,694 g / cm3
Solubilità
In acqua: moderatamente solubile.
- 1 g in 87 ml di acqua
- 1 g in 3 ml di acqua bollente
In etanolo: 1 g in 6 ml di alcol.
In etere dietilico: 1 g in 100 ml di etere.
In glicerolo: 1 g in 10 ml di glicerolo.
In acetone: 1 g in 5 ml di acetone.
Praticamente insolubile in benzene, cloroformio e petrolio leggero.
Costante di dissociazione
K1 4,63 x 10-3 (a 30 ºC).
KDue 1,41 x 10-9
Proprietà chimiche
Le soluzioni di acido gallico, in particolare i sali di metalli alcalini, assorbono ossigeno e diventano marroni se esposte all'aria.
L'acido gallico è un forte agente riducente che può ridurre i sali d'oro o d'argento al metallo. È incompatibile con clorati, permanganato, ammoniaca, acetato di piombo, idrossidi alcalini, carbonati alcalini, sali d'argento e agenti ossidanti in genere..
Con i sali di ferro (II), l'acido gallico forma un complesso blu intenso.
Nell'acido gallico, il gruppo idrossile (-OH) in posizione 4 è il più reattivo chimicamente.
Altre proprietà
Deve essere protetto dalla luce perché lo degrada fotochimicamente.
È un lieve irritante locale. L'inalazione di polvere può danneggiare il naso e la gola e il contatto con gli occhi e la pelle provoca irritazione..
Studi di tossicità sui topi indicano che ingerito fino a un livello di 5000 mg / kg, l'acido gallico non è tossico per questi animali. È considerato a bassa tossicità e conferma la sicurezza del suo utilizzo.
Ottenere
L'acido gallico si ottiene per idrolisi alcalina o acida dei tannini delle noci o di materiali vegetali ricchi di questi composti..
L'idrolisi può anche essere eseguita enzimaticamente utilizzando brodi di coltura di muffe come Penicillium glaucum o il Aspergillus niger, che contengono tannasi, un enzima che rompe o scinde la molecola di tannino.
Un altro modo per ottenere l'acido gallico è dall'acido p-idrossibenzoico, per solfonazione e fusione alcalina, con cui si ottiene l'aggiunta degli altri due gruppi -OH nella molecola..
Applicazioni
- In inchiostri e coloranti
L'acido gallico è utilizzato nella produzione di antragalolo e pirogallolo, che sono intermediari nella produzione di coloranti, come la gallocianina e la galoflavina. A sua volta, è una materia prima nella sintesi dei derivati dell'ossazina, che vengono utilizzati anche come coloranti..
Poiché forma un complesso blu con il ferro, l'acido gallico è molto importante nella produzione di inchiostri da scrittura. Questi inchiostri contengono principalmente una miscela di acido gallico, solfato ferroso (FeSO4) e gomma arabica.
Gli inchiostri a base di acido gallico di ferro sono stati materiali indispensabili per scrivere documenti, disegnare piani e preparare materiale scritto..

- Nelle applicazioni mediche
È usato come astringente intestinale e agente di arresto del sanguinamento (emostatico). L'acido gallico è la materia prima per ottenere il rufigalolo, che è un agente antimalarico..
A causa della sua capacità di riduzione chimica, l'acido gallico viene utilizzato nella fabbricazione di prodotti farmaceutici..
- In potenziali applicazioni mediche
Contro il cancro
L'acido gallico è stato identificato come il principale responsabile delle proprietà antitumorali di diversi estratti vegetali.
Contrariamente alla sua particolare azione antiossidante, è stato riscontrato che può presentare caratteristiche pro-ossidanti nell'induzione dell'apoptosi delle cellule tumorali. L'apoptosi è la distruzione ordinata delle cellule danneggiate causata dallo stesso organismo.
Ci sono prove che l'acido gallico e i gallati inducono l'apoptosi selettiva nelle cellule tumorali in rapida crescita, lasciando intatte le cellule sane. Inoltre, è stato riportato che rallenta l'angiogenesi e, di conseguenza, l'invasione del cancro e le metastasi.
L'attività antitumorale dell'acido gallico è stata riscontrata nella leucemia, cancro alla prostata, ai polmoni, allo stomaco, al pancreas e al colon, al seno, cervicale ed esofageo..
Contro varie patologie
In diversi studi è stato dimostrato che possiede attività antimicotica, antibatterica, antivirale, antiallergica, antinfiammatoria, antimutagena, anticolesterolo, antiobesità e immunomodulante.
L'acido gallico è un buon candidato per il controllo della malattia parodontale (malattia gengivale).
Presenta anche potenziale neuroprotettivo, cardioprotettivo, epatoprotettivo e nefroprotettivo. Ad esempio, diversi studi sui tessuti cardiaci nei ratti hanno confermato che l'acido gallico esercita un effetto protettivo sul miocardio contro lo stress ossidativo.
Come agente antietà cellulare
L'acido gallico fornisce una protezione efficiente contro i danni ossidativi causati da specie reattive spesso presenti nei sistemi biologici, come i radicali idrossilici (OH.), superossido (ODue.) e perossile (ROO.).
È stato riscontrato che viene assorbito più velocemente dal tratto digestivo rispetto alla maggior parte dei polifenoli. Ed è uno di quelli con la più alta capacità antiossidante.
Inoltre, alcuni ricercatori affermano che l'acido gallico può essere trasportato dai niosomi per aumentare la sua attività antietà. Il niosoma è un sistema molecolare per il rilascio controllato di farmaci al posto dell'organismo che lo richiede.
Queste caratteristiche gli conferiscono un alto potenziale contro l'invecchiamento cellulare..
- Negli usi veterinari
È stato usato come astringente intestinale negli animali.
- In varie applicazioni
L'acido gallico viene utilizzato nella produzione dei suoi esteri, come metil gallato, propil gallato, ottil gallato e lauril gallato..
Questi derivati sono ampiamente usati come antiossidanti e conservanti negli alimenti trasformati, nei materiali di confezionamento degli alimenti, per prevenire l'irrancidimento e il deterioramento ossidativo. I derivati citati sono utilizzati anche nei cosmetici.
L'acido gallico è usato come sviluppatore fotografico e nella produzione di carta. Inoltre, è ampiamente utilizzato nella stabilizzazione del collagene nel processo di concia delle pelli..
Come reagente analitico, l'acido gallico è ideale come standard per determinare il contenuto fenolico degli estratti vegetali ei risultati sono espressi come equivalenti di acido gallico..
Viene anche utilizzato nei test per la determinazione di acidi minerali liberi, diidrossiacetone e alcaloidi..
- Utilità in ambienti acquatici naturali
L'acido gallico, naturalmente presente negli acquiferi nella materia vegetale, è uno di quelli responsabili della disponibilità nutritiva di Fe (II) necessaria per la crescita delle specie acquatiche.
Questo perché è in grado di mantenere alti livelli di concentrazione di ferro disciolto (II) in condizioni aerobiche. Questo perché forma un complesso con Fe (II) resistente all'ossidazione..

Riferimenti
- Sajid, M. et al. (2019). Consegna basata su nanoparticelle di fitomedicina: sfide e opportunità. In un nuovo sguardo alla fitomedicina. Capitolo 23. Recupero da sciencedirect.com.
- Windholz, M .; Budavari, S .; Blumetti, R. F. e Otterbein, E. (editori) (1983). L'indice Merck. Decima edizione. Merck & CO., Inc.
- Manuale CRC di chimica e fisica. 75th 1994. CRC Press, Inc.
- Enciclopedia della chimica industriale di Ullmann. (1990). Quinta edizione. Volume A13. VCH Verlagsgesellschaft mbH.
- Badhani, B; Sharma, N. e Kakkar, R. (2015). Acido gallico: un antiossidante versatile con promettenti applicazioni terapeutiche e industriali. Progressi di RSC. Recuperato da rsc.org.
- Zanwar, Anand A., et al. (2014). Ruolo dell'acido gallico nei disturbi cardiovascolari. Nei polifenoli nella salute umana e nelle malattie. Capitolo 80. Recupero da sciencedirect.com.
- Nowak, R. et al. (2014). Polifenoli vegetali come agenti chemiopreventivi. Nei polifenoli nella salute umana e nelle malattie. Capitolo 97. Recupero da sciencedirect.com.



Nessun utente ha ancora commentato questo articolo.