
Proprietà, rischi e usi dell'acido fosforoso (H3PO3)

Il acido fosforoso, chiamato anche acido ortofosforoso, è un composto chimico di formula H.3PO3. È uno dei vari acidi ossigenati del fosforo e la sua struttura è presentata nella figura 1 (EMBL-EBI, 2015).
Data la formula del composto, può essere riscritto come HPO (OH)Due. Questa specie esiste in equilibrio con un tautomero minore P (OH)3 (Figura 2).

Le raccomandazioni IUPAC, 2005 sono che quest'ultimo è chiamato acido fosforoso, mentre la forma diidrossi è chiamata acido fosfonico. Solo i composti di fosforo ridotti sono scritti con un finale "orso"..

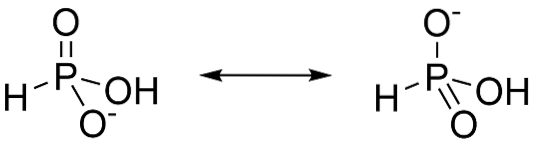
L'acido fosforoso è un acido diprotico, questo significa che ha solo la capacità di rinunciare a due protoni. Questo perché il più tautomero è H.3PO3. Quando questa forma perde un protone, la risonanza stabilizza gli anioni formati, come mostrato in figura 3.
Il tautomero P (OH) 3 (Figura 4) non ha il vantaggio della stabilizzazione della risonanza. Ciò rende la rimozione del terzo protone molto più difficile (Perché l'acido fosforoso è diprotico e non triprotico?, 2016).

Acido fosforico (H3PO3) forma sali chiamati fosfiti, che vengono utilizzati come agenti riducenti (Britannica, 1998). Si prepara sciogliendo esossido tetrafosforico (P4O6) secondo l'equazione:
P4O6 + 6 hDueO → 4 HPO (OH)Due
Acido fosforoso puro, H.3PO3, meglio preparato per idrolisi del fosforo tricloruro, PCl3.
PCl3 + 3HDueO → HPO (OH)Due + 3HCl
La soluzione risultante viene riscaldata per allontanare l'HCl e l'acqua rimanente viene evaporata fino a quando non appare 3PO3 cristallino incolore per raffreddamento. L'acido può essere ottenuto anche dall'azione dell'acqua su PBr3 o PI3 (Zumdahl, 2018).
Indice articolo
- 1 Proprietà fisiche e chimiche
- 2 Reattività e pericoli
- 2.1 Reattività
- 2.2 Pericoli
- 2.3 Azione in caso di danno
- 3 usi
- 4 Riferimenti
Proprietà fisiche e chimiche
L'acido fosforoso è costituito da cristalli tetraedrici igroscopici bianchi o gialli con un aroma simile all'aglio (National Center for Biotechnology Information, 2017).

La H3PO3 ha un peso molecolare di 82,0 g / mol e una densità di 1,651 g / ml. Il composto ha un punto di fusione di 73 ° C e si decompone sopra i 200 ° C. L'acido fosforoso è solubile in acqua, essendo in grado di sciogliere 310 grammi per 100 ml di questo solvente. È anche solubile in etanolo.
Inoltre, è un acido forte con un pKa compreso tra 1,3 e 1,6 (Royal Society of Chemistry, 2015).
Il riscaldamento dell'acido fosforoso a circa 200 ° C ne provoca la sproporzione in acido fosforico e fosfina (PH3). Fosfina, un gas che normalmente si accende spontaneamente nell'aria.
4H3PO3 + calore → PH3 + 3H3PO4
Reattività e rischi
Reattività
- L'acido fosforoso non è un composto stabile.
- Assorbe l'ossigeno dall'aria per formare acido fosforico.
- Forma depositi gialli in soluzione acquosa spontaneamente infiammabili all'essiccamento.
- Reagisce esotermicamente con basi chimiche (ad esempio: ammine e idrossidi inorganici) per formare sali.
- Queste reazioni possono generare quantità di calore pericolosamente elevate in piccoli spazi..
- La dissoluzione in acqua o la diluizione di una soluzione concentrata con altra acqua può generare un calore significativo.
- Reagisce in presenza di umidità con metalli attivi, inclusi metalli strutturali come alluminio e ferro, rilasciando idrogeno, un gas infiammabile.
- Può avviare la polimerizzazione di alcuni alcheni. Reagisce con i composti di cianuro per rilasciare acido cianidrico gassoso.
- Può generare gas infiammabili e / o tossici a contatto con ditiocarbammati, isocianati, mercaptani, nitruri, nitrili, solfuri e forti agenti riducenti.
- Ulteriori reazioni che generano gas si verificano con solfiti, nitriti, tiosolfati (per dare H2S e SO3), ditioniti (per dare SO2) e carbonati (per dare CO2) (ACIDO FOSFOROSO, 2016).
Pericoli
- Il composto è corrosivo per gli occhi e la pelle.
- Il contatto con gli occhi può provocare danni alla cornea o cecità..
- Il contatto con la pelle può causare infiammazioni e vesciche.
- L'inalazione di polvere provoca irritazione del tratto gastrointestinale o respiratorio, caratterizzata da bruciore, starnuti e tosse..
- Una grave sovraesposizione può causare danni ai polmoni, soffocamento, perdita di conoscenza o morte (Scheda di sicurezza del materiale Acido fosforoso, 2013).
Azione in caso di danni
- Garantire che il personale medico sia a conoscenza dei materiali coinvolti e prenda precauzioni per proteggersi.
- La vittima deve essere spostata in un luogo fresco e deve essere chiamato il servizio medico di emergenza.
- Se la vittima non respira, deve essere praticata la respirazione artificiale.
- Il metodo bocca a bocca non deve essere utilizzato se la vittima ha ingerito o inalato la sostanza..
- La respirazione artificiale viene eseguita con l'ausilio di una maschera tascabile dotata di valvola unidirezionale o altro idoneo dispositivo medico respiratorio.
- L'ossigeno dovrebbe essere somministrato se la respirazione è difficile.
- Gli indumenti e le scarpe contaminati devono essere rimossi e isolati.
- In caso di contatto con la sostanza, sciacquare immediatamente la pelle o gli occhi con acqua corrente per almeno 20 minuti..
- Per un minore contatto con la pelle, evitare di spargere il materiale sulla pelle sana..
- Mantieni la vittima calma e al caldo.
- Gli effetti dell'esposizione (inalazione, ingestione o contatto con la pelle) alla sostanza possono essere ritardati.
Applicazioni
L'uso più importante dell'acido fosforoso è la produzione di fosfiti che vengono utilizzati nel trattamento delle acque. L'acido fosforico viene anche utilizzato per preparare sali di fosfito, come il fosfito di potassio..
I fosfiti hanno dimostrato di essere efficaci nel controllare una varietà di malattie delle piante.
In particolare, il trattamento mediante iniezione di tronco o fogliare contenente sali di acido fosforoso è indicato in risposta alle infezioni da agenti patogeni delle piante di tipo phytoftera e pythium (provocano la decomposizione delle radici).
L'acido fosforoso e i fosfiti sono usati come agenti riducenti nelle analisi chimiche. Una nuova sintesi conveniente e scalabile di acidi fenilacetici, attraverso la riduzione catalizzata da ioduro degli acidi mandelici, si basa sulla generazione in situ di acido idroiodico da ioduro di sodio catalitico. Per questo, l'acido fosforico viene utilizzato come riduttore stechiometrico (Jacqueline E. Milne, 2011).
È utilizzato come ingrediente per la produzione di additivi utilizzati nell'industria del cloruro di polivinile (Acido fosforoso (CAS RN 10294-56-1), 2017). Anche gli esteri dell'acido fosforoso sono utilizzati in varie reazioni di sintesi organica (Blazewska, 2009).
Riferimenti
- Blazewska, K. (2009). Scienza della sintesi: metodi Houben-Weyl delle trasformazioni molecolari Vol 42. New York: Thieme.
- (1998, 20 luglio). Acido fosforoso (H3PO3). Estratto da Encyclopædia Britannica: britannica.com.
- EMBL-EBI. (2015, 20 luglio). acido fosfonico. Recupero da ebi.ac.uk: ebi.ac.uk.
- Jacqueline E. Milne, T. S. (2011). Riduzioni catalizzate da ioduro: sviluppo di una sintesi di acidi fenilacetici. Org. Chem.76, 9519-9524. organic-chemistry.org.
- Scheda di sicurezza del materiale Acido fosforoso. (2013, 21 maggio). Recupero da sciencelab: sciencelab.com.
- Centro nazionale per le informazioni sulla biotecnologia. (2017, 11 marzo). Database composto di PubChem; CID = 107909. Estratto da PubChem: ncbi.nlm.nih.gov.
- Acido fosforoso (CAS RN 10294-56-1). (2017, 15 marzo). Recupero da gov.uk/trade-tariff:gov.uk.
- ACIDO FOSFOROSO. (2016). Estratto da cameochemicals: cameochemicals.noaa.gov.
- Royal Society of Chemistry. (2015). ACIDO FOSFOROSO. Estratto da chemspider: chemspider.com.
- Perché l'acido fosforoso è diprotico e non triprotico? (2016, 11 marzo). Recupero da chemistry.stackexchange.
- Zumdahl, S. S. (2018, 15 agosto). Ossiacido. Recuperato da britannica.com.

Nessun utente ha ancora commentato questo articolo.