
Struttura, proprietà, nomenclatura e usi dell'acido disolforico
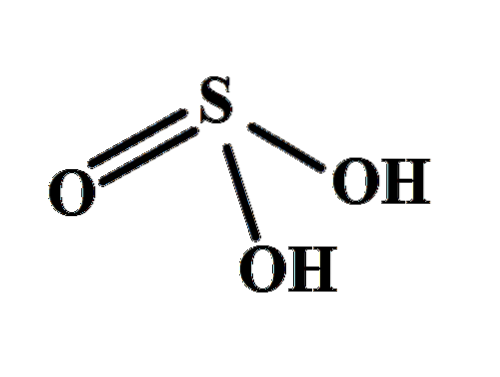
Il acido disolforico è uno dei tanti ossoacidi di zolfo, la cui formula chimica è H.DueSDueO7. La formula afferma esplicitamente che ci sono due atomi di zolfo e, come indica anche il nome, devono esserci due molecole di HDueSW4 solo uno; tuttavia, ci sono sette ossigeni invece di otto, quindi uno zolfo deve averne tre.
Questo acido è considerato uno dei componenti principali dell'oleum (o acido solforico fumante), che è una forma "densa" di acido solforico. Tale è la sua predominanza, che alcuni considerano oleum come sinonimo di acido disolforico; che è anche conosciuto con il nome tradizionale di acido pirosolforico.

L'immagine mostra un contenitore con oleum, con una concentrazione di anidride solforosa, SO3, al 20%. Questa sostanza è caratterizzata dall'essere oleosa e incolore; sebbene possa diventare giallastro o marrone a seconda della concentrazione di SO3 e la presenza di alcune impurità.
Quanto sopra si riferisce alla partecipazione della CA3 nella HDueSDueO7; cioè una molecola di HDueSW4 reagire con un SO3 per formare acido disolforico. Stando così le cose, l'HDueSDueO7 può anche essere scritto come H.DueSW4· SW3.
Indice articolo
- 1 Struttura dell'acido disolforico
- 2 Proprietà
- 2.1 Reazione di disidratazione dello zucchero
- 3 Nomenclatura
- 4 Usi
- 4.1 Memorizza acido solforico
- 4.2 Sintesi di acido solforico al 100%
- 4.3 solfonazione
- 5 Riferimenti
Struttura dell'acido disolforico
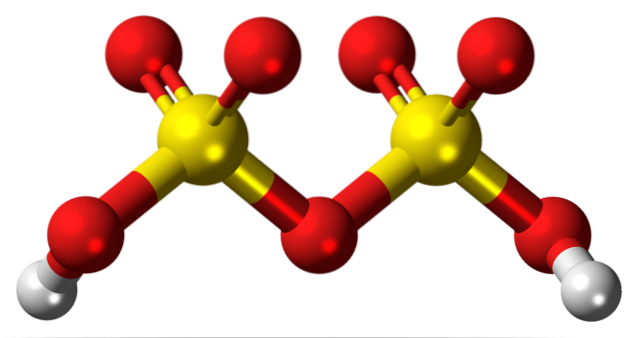
Sopra è la struttura di H.DueSDueO7 in un modello di sfere e barre. Notare a prima vista la simmetria della molecola: il lato sinistro del ponte dell'ossigeno è identico a quello destro. Da quella prospettiva, la struttura può essere descritta con la formula HO3COSÌ COSÌ3H.
Ad entrambe le estremità si trova ciascun gruppo idrossile, il cui idrogeno, per effetto induttivo di tutti questi atomi di ossigeno, aumenta la sua carica parziale positiva; e di conseguenza, l'acido disolforico ha un'acidità ancora più forte dell'acido solforico.
La molecola può essere scritta come H.DueSW4· SW3. Tuttavia, questo si riferisce più a una composizione di oleum che alla struttura di una molecola..
Tuttavia, se una molecola d'acqua viene aggiunta a H.DueSDueO7, verranno rilasciate due molecole di H.DueSW4:
HDueSDueO7 + HDueO <=> 2HDueSW4
L'equilibrio può spostarsi a sinistra: alla formazione di H.DueSDueO7 da HDueSW4 se gli viene fornito calore. È per questo motivo che in H.DueSDueO7 è anche noto come acido pirosolforico; in quanto può essere generato dopo aver riscaldato l'acido solforico.
Inoltre, come accennato all'inizio, l'HDueSDueO7 è formato dalla combinazione diretta di H.DueSW4 E così3:
SW3 + HDueSW4 <=> HDueSDueO7
Proprietà
Le proprietà dell'acido disolforico non sono molto ben definite, perché è estremamente difficile isolarlo puramente dall'oleum.
Va ricordato che in oleum possono esserci altri composti, con formule H.DueSW4XSO3, dove a seconda del valore di x puoi persino avere strutture polimeriche.
Un modo per visualizzarlo è immaginare che la struttura superiore di H.DueSDueO7 diventa più allungato da più unità di SO3 e ponti di ossigeno.
Allo stato quasi puro, è costituito da un solido cristallino instabile (fumante) che si scioglie a 36ºC. Tuttavia, questo punto di fusione può variare a seconda della vera composizione..
L'acido disolforico può formare i cosiddetti sali disolfato (o pirosolfato). Ad esempio, se reagisce con l'idrossido di potassio, forma pirosolfato di potassio, KDueSDueO7.
Inoltre, si può commentare che ha un peso molecolare di 178 g / mol e due equivalenti acidi (2 H ioni+ che può essere neutralizzato con una base forte).
Reazione di disidratazione dello zucchero
Con questo composto sotto forma di oleum si può realizzare una curiosa reazione: la trasformazione dei cubetti di zucchero in blocchi di carbonio.
La HDueSDueO7 reagisce con gli zuccheri eliminando tutti i loro gruppi OH sotto forma di acqua, cosa che favorisce nuovi legami tra atomi di carbonio; articolazioni che finiscono per causare carbonio nero.
Nomenclatura
L'acido disolforico è considerato l'anidride dell'acido solforico; cioè perde una molecola d'acqua a causa della condensazione tra due molecole di acido. Dati così tanti nomi possibili per questo composto, la nomenclatura IUPAC raccomanda semplicemente l'acido disolforico..
Il termine "pirofila" si riferisce esclusivamente a quello formato come prodotto dell'applicazione del calore. La IUPAC non consiglia questo nome per l'HDueSDueO7; ma è ancora usato oggi da molti chimici.
La desinenza -ico rimane invariata poiché l'atomo di zolfo continua a mantenere una valenza di +6. Ad esempio, può essere calcolato utilizzando la seguente operazione aritmetica:
2H + 2S + 7O = 0
2 (+1) + 2S + 7 (-2) = 0
S = 6
Applicazioni
Memorizza l'acido solforico
L'acido disolforico, data la sua proprietà di solidificare come l'oleum, è in grado di sciogliere e immagazzinare l'acido solforico in modo più sicuro. Questo perché il sistema operativo3 fuoriesce creando una "nebbia" irrespirabile, molto più solubile in HDueSW4 che in acqua. Per ottenere l'HDueSW4, basterebbe aggiungere acqua ad oleum:
HDueSDueO7 + HDueO <=> 2HDueSW4
Sintesi di acido solforico al 100%
Dall'equazione di cui sopra, l'HDueSW4 viene diluito nell'acqua aggiunta. Ad esempio, se hai una soluzione acquosa di H.DueSW4, dove il SO3 Tende a fuoriuscire e rappresenta un rischio per i lavoratori, quando si aggiunge oleum alla soluzione reagisce con l'acqua formando più acido solforico. cioè aumentando la tua concentrazione.
Se rimane dell'acqua, viene aggiunta altra SO3, che reagisce con HDueSW4 per produrre più acido disolforico o oleum, e quindi questo viene reidratato "asciugando" l'HDueSW4. Il processo viene ripetuto abbastanza volte per ottenere acido solforico ad una concentrazione del 100%.
Un processo simile viene utilizzato per ottenere il 100% di acido nitrico. Allo stesso modo, è stato utilizzato per disidratare altre sostanze chimiche, utilizzate per produrre esplosivi..
Solfonazione
È usato per solfonare strutture, come quelle dei coloranti; cioè, aggiungi -SO gruppi3H, che perdendo il suo protone acido può ancorarsi al polimero della fibra tessile.
D'altra parte, l'acidità dell'oleum viene utilizzata per ottenere la seconda nitrazione (aggiungere gruppi -NODue) agli anelli aromatici.
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (quarta edizione). Mc Graw Hill.
- Wikipedia. (2018). Acido disolforico. Estratto da: en.wikipedia.org
- PubChem. (2019). Acido pirosolforico. Estratto da: pubchem.ncbi.nlm.nih.gov
- Seong Kyu Kim, Han Myoung Lee e Kwang S. Kim. (2015). Acido disolforico dissociato da due molecole d'acqua: calcoli di teoria del funzionale ab initio e densità. Phys. Chem. Chem. Phys., 2015, 17, 28556
- Contra Costa Health Services. (s.f.). Oleo / triossido di zolfo: scheda chimica. [PDF]. Estratto da: cchealth.org

Nessun utente ha ancora commentato questo articolo.