
Struttura, proprietà, produzione e usi dell'acido citrico
Il acido citrico è un composto organico costituito da un acido debole la cui formula chimica è C6H8O7. Come indica il nome, una delle sue principali fonti naturali sono gli agrumi, e deriva anche dalla parola latina "citrus", che significa amaro..
Non solo è un acido debole, è anche poliprotico; cioè, può rilasciare più di uno ione idrogeno, H+. È precisamente un acido tricarbossilico, quindi ha tre gruppi -COOH che donano ioni H.+. Ognuno di loro ha la propria tendenza a liberarsi nel proprio ambiente..

Pertanto, la sua formula strutturale è meglio definita come C3H5O (COOH)3. Questa è la ragione chimica del suo contributo al sapore caratteristico, ad esempio, degli spicchi d'arancia. Sebbene provenga dai frutti, i suoi cristalli non furono isolati fino al 1784 da un succo di limone in Inghilterra.
Costituisce circa l'8% in massa di alcuni agrumi, come limoni e pompelmi. Può anche essere trovato in peperoni, pomodori, carciofi e altri alimenti..
Indice articolo
- 1 Dove si trova l'acido citrico?
- 2 Struttura dell'acido citrico
- 2.1 Interazioni intermolecolari
- 3 Proprietà fisiche e chimiche
- 3.1 Peso molecolare
- 3.2 Aspetto fisico
- 3.3 Aroma
- 3.4 Punto di fusione
- 3.5 Punto di ebollizione
- 3.6 Densità
- 3.7 Solubilità
- 3.8 pKa
- 3.9 Decomposizione
- 3.10 Derivati
- 4 Produzione
- 4.1 Sintesi chimica o sintetica
- 4.2 Naturale
- 4.3 Per fermentazione
- 5 Usi
- 5.1 Nell'industria alimentare
- 5.2 Nell'industria farmaceutica
- 5.3 Nell'industria cosmetica e in generale
- 6 Tossicità
- 7 Riferimenti
Dove si trova l'acido citrico?
Si trova in basse proporzioni in tutte le piante e gli animali ed è un metabolita degli esseri viventi. È un composto intermedio del metabolismo aerobico presente nel ciclo dell'acido tricarbossilico o nel ciclo dell'acido citrico. In biologia o biochimica questo ciclo è noto anche come il ciclo di Krebs, una via del metabolismo anfibolo.
Oltre ad essere naturalmente presente nelle piante e negli animali, questo acido si ottiene sinteticamente su larga scala attraverso la fermentazione..
È ampiamente utilizzato nell'industria alimentare, farmaceutica e chimica e si comporta come un conservante naturale. Esso ei suoi derivati sono prodotti in modo massiccio a livello industriale per aromatizzare cibi solidi e liquidi.
Trova l'uso come additivo in varietà di prodotti per la bellezza della pelle; è anche usato come agente chelante, acidificante e antiossidante. Tuttavia, il suo utilizzo in concentrazioni elevate o pure non è raccomandato; poiché può causare irritazioni, allergie e persino cancro.
Struttura dell'acido citrico
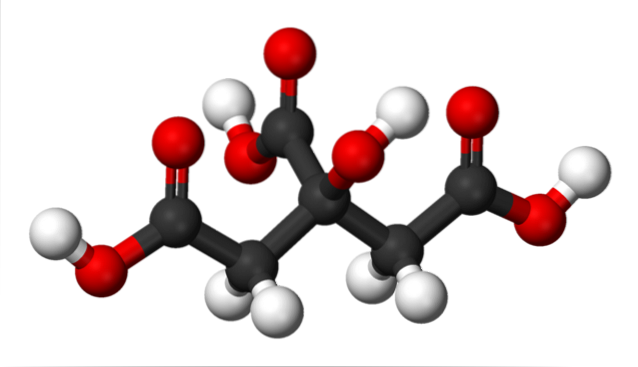
Nell'immagine in alto la struttura dell'acido citrico è rappresentata con un modello di sfere e barrette. Se guardi da vicino, puoi trovare lo scheletro di soli tre atomi di carbonio: il propano.
L'atomo di carbonio al centro è legato a un gruppo -OH, che in presenza di gruppi carbossilici, -COOH, adotta la terminologia 'idrossi'. I tre gruppi -COOH sono facilmente riconoscibili alle estremità sinistra e destra, e nella parte superiore della struttura; È da questi che vengono rilasciate le H.+.
D'altra parte, il gruppo -OH è anche in grado di perdere un protone acido, quindi in totale non ci sarebbero tre H+, ma quattro. Quest'ultimo però richiede una base considerevolmente forte e, di conseguenza, il suo contributo all'acidità caratteristica dell'acido citrico è molto inferiore rispetto a quello dei gruppi -COOH..
Da tutto quanto sopra segue che l'acido citrico può anche essere chiamato: propano 2-idrossi-1,2,3-tricarbossilico.
C'è un gruppo -OH in C-2, che è adiacente al gruppo -COOH (guarda in alto al centro della struttura). Per questo motivo anche l'acido citrico rientra nella classificazione degli alfa-idrossiacidi; dove alfa significa 'adiacente', cioè c'è solo un atomo di carbonio che separa -COOH e -OH.
Interazioni intermolecolari
Come si può vedere, la struttura dell'acido citrico ha un'elevata capacità di donare e accettare legami idrogeno. Questo lo rende molto legato all'acqua, e anche il motivo per cui forma un solido monoidrato, cristalli romboedrici, molto facilmente..
Questi legami idrogeno sono anche responsabili dell'erezione dei cristalli monoclinici incolori di acido citrico. Cristalli anidri (senza acqua) possono essere ottenuti dopo la formazione in acqua calda, seguita da completa evaporazione..
Proprietà fisiche e chimiche
Peso molecolare
210,14 g / mol.
Aspetto fisico
Cristalli acidi incolori e inodori.
Gusto
Aspro e amaro.
Punto di fusione
153 ° C.
Punto di ebollizione
175 ° C.
Densità
1,66 g / mL.
Solubilità
È un composto altamente solubile in acqua. È anche molto solubile in altri solventi polari come l'etanolo e l'acetato di etile. In solventi apolari e aromatici come benzene, toluene, cloroformio e xilene, è insolubile.
pKa
-3.1
-4.7
-6.4
Questi sono i valori pKa per ciascuno dei tre gruppi -COOH. Si noti che il terzo pKa (6,4) è appena leggermente acido, quindi si dissocia poco.
Decomposizione
A temperature estreme o superiori a 175 ° C si decompone rilasciando CODue e acqua. Pertanto, il liquido non raggiunge un'ebollizione significativa poiché si decompone per primo..
Derivati
Man mano che perdi H.+, altri cationi prendono il loro posto ma in modo ionico; cioè le cariche negative dei gruppi -COO- attirare altre specie di cariche positive, come Na+. Più è deprotonato l'acido citrico, più cationi avranno i suoi derivati chiamati citrati.
Un esempio è il citrato di sodio, che ha un effetto chelante molto utile come coagulante. Questi citrati possono quindi formare complessi con metalli in soluzione..
D'altra parte, l'H+ dei gruppi -COOH possono anche essere sostituiti da altre specie legate covalentemente, come le catene laterali R, dando origine a esteri citrati: C3H5O (COOR)3.
La diversità è molto grande, poiché non tutto H deve essere necessariamente sostituito da R, ma anche da cationi.
Produzione
L'acido citrico può essere prodotto naturalmente e commercialmente ottenuto dalla fermentazione dei carboidrati. La sua produzione è stata effettuata anche sinteticamente attraverso processi chimici oggi poco attuali..
Diversi processi biotecnologici sono stati utilizzati per la sua produzione, poiché questo composto è molto richiesto in tutto il mondo.
Sintesi chimica o sintetica
-Uno di questi processi di sintesi chimica viene effettuato in condizioni di alta pressione da sali di calcio di isocitrato. Il succo estratto dagli agrumi viene trattato con idrossido di calcio e si ottiene citrato di calcio..
Questo sale viene quindi estratto e fatto reagire con una soluzione di acido solforico diluito, la cui funzione è quella di protonare il citrato alla sua forma acida originale..
-L'acido citrico è stato anche sintetizzato dalla glicerina sostituendo i suoi componenti con un gruppo carbossilico. Come appena accennato, questi processi non sono ottimali per la produzione di acido citrico su larga scala..
naturale
Nel corpo, l'acido citrico si trova naturalmente nel metabolismo aerobico: il ciclo dell'acido tricarbossilico. Quando l'acetil coenzima A (acetil-CoA) entra nel ciclo, si lega con l'acido ossalacetico, formando acido citrico..
E da dove viene l'acetil-CoA?
Nelle reazioni del catabolismo degli acidi grassi, i carboidrati, tra gli altri substrati, in presenza di ODue viene prodotto acetil-CoA. Si forma come prodotto della beta ossidazione degli acidi grassi, della trasformazione del piruvato generato nella glicolisi.
L'acido citrico formato nel ciclo di Krebs o nel ciclo dell'acido citrico sarà ossidato ad acido alfa-chetoglutarico. Questo processo rappresenta un percorso di riduzione dell'ossidazione anfibolica, da cui vengono generati equivalenti che produrranno quindi energia o ATP..
Tuttavia, la produzione commerciale di acido citrico come intermedio del metabolismo aerobico non è stata né redditizia né soddisfacente. Solo in condizioni di squilibrio organico può essere aumentata la concentrazione di questo metabolita, che non è vitale per i microrganismi.
Per fermentazione
I microrganismi, come funghi e batteri, producono acido citrico facendo fermentare gli zuccheri.
La produzione di acido citrico dalla fermentazione microbica ha dato risultati migliori rispetto a ottenerlo per sintesi chimica. Sono state sviluppate linee di ricerca legate a questo metodo di produzione commerciale di massa, che ha offerto grandi vantaggi economici..
Le tecniche di coltivazione a livello industriale sono variate nel tempo. Sono state utilizzate colture per fermentazione superficiale e sommersa. Le colture sommerse sono quelle in cui i microrganismi producono fermentazione da substrati contenuti in mezzi liquidi.
I processi di produzione dell'acido citrico per fermentazione sommersa, che avviene in condizioni anaerobiche, sono stati ottimali..
Ad alcuni funghi piace Aspergillus niger, Saccahromicopsis sp, e batteri come Bacillus licheniformis, hanno permesso di ottenere una resa elevata con questo tipo di fermentazione.
Funghi piace Aspergillus niger o candida sp, Producono acido citrico come risultato della fermentazione di melassa e amido. Anche lo zucchero di canna, mais e barbabietola, tra gli altri, sono usati come substrati di fermentazione..
Applicazioni
L'acido citrico è ampiamente utilizzato nell'industria alimentare, nella fabbricazione di prodotti farmaceutici. Viene anche utilizzato in innumerevoli processi chimici e biotecnologici..
Nell'industria alimentare
-L'acido citrico è utilizzato principalmente nell'industria alimentare in quanto conferisce loro un piacevole sapore acido. È molto solubile in acqua, quindi viene aggiunto a bevande, dolci, caramelle, gelatine e frutta congelata. Viene anche utilizzato nella preparazione di vini, birre e altre bevande..
-Oltre ad aggiungere un sapore acido, inattiva gli oligoelementi proteggendo l'acido ascorbico o la vitamina C. Agisce anche come emulsionante in gelati e formaggi. Contribuisce all'inattivazione degli enzimi ossidativi abbassando il pH degli alimenti.
-Aumenta l'efficacia dei conservanti aggiunti agli alimenti. Fornendo un pH relativamente basso, diminuisce la probabilità che i microrganismi sopravvivano negli alimenti trasformati, aumentando così la loro durata..
-Nei grassi e negli oli, l'acido citrico viene utilizzato per rafforzare l'effetto antiossidante sinergico (di tutti i componenti grassi) che questo tipo di nutrienti può avere..
Nell'industria farmaceutica
-L'acido citrico è anche ampiamente utilizzato come eccipiente nell'industria farmaceutica per migliorare il gusto e la dissoluzione dei medicinali..
-In combinazione con il bicarbonato, l'acido citrico viene aggiunto ai prodotti in polvere e in compresse in un modo che agisce come un effervescente.
-I sali dell'acido citrico ne consentono l'uso come anticoagulante, poiché ha la capacità di chelare il calcio. L'acido citrico viene somministrato in integratori minerali come i sali di citrato.
-Acidificando il mezzo del processo di assorbimento a livello intestinale, l'acido citrico ottimizza l'assorbimento delle vitamine e di alcuni medicinali. La sua forma anidra viene somministrata in aggiunta ad altri farmaci nella dissoluzione dei calcoli.
-Viene anche utilizzato come acidificante, astringente, come agente che facilita lo scioglimento dei principi attivi di vari prodotti farmaceutici..
Nell'industria cosmetica e in generale
-L'acido citrico è usato come agente chelante per gli ioni metallici negli articoli da toeletta e nei cosmetici..
-Viene utilizzato per pulire e lucidare i metalli in genere, rimuovendo l'ossido che li ricopre.
-A basse concentrazioni funge da additivo nei prodotti per la pulizia ecologici, che sono benigni per l'ambiente e la natura..
-Ha un'ampia varietà di usi: viene utilizzato nei reagenti fotografici, nei tessuti, nella concia delle pelli.
-Si aggiunge agli inchiostri da stampa.
Tossicità
I rapporti sulla sua tossicità sono associati ad un'alta concentrazione di acido citrico, tempo di esposizione, impurità, tra gli altri fattori..
Le soluzioni di acido citrico diluite non rappresentano alcun rischio o pericolo per la salute. Tuttavia, l'acido citrico puro o concentrato rappresenta un rischio per la sicurezza e quindi non dovrebbe essere consumato..
Puro o concentrato, è corrosivo e irritante a contatto con la pelle e le mucose di occhi, naso e gola. Può provocare reazioni allergiche cutanee e tossicità acuta se ingerito..
L'inalazione di polvere di acido citrico puro può anche interessare la mucosa delle vie respiratorie. L'inalazione può causare mancanza di respiro, allergie, sensibilizzazione della mucosa respiratoria e può persino scatenare l'asma.
Sono segnalati effetti tossici sulla riproduzione. L'acido citrico può causare difetti genetici, provocando la mutazione nelle cellule germinali.
Infine, è considerato pericoloso o tossico per l'habitat acquatico, e in generale l'acido citrico concentrato è corrosivo per i metalli..
Riferimenti
- BellChem (21 aprile 2015). Gli usi dell'acido citrico nell'industria alimentare. Estratto da: bellchem.com
- Vandenberghe, Luciana P. S, Soccol, Carlos R, Pandey, Ashok e Lebeault, Jean-Michel. (1999). Produzione microbica di acido citrico. Archivi brasiliani di biologia e tecnologia, 42 (3), 263-276. dx.doi.org/10.1590/S1516-89131999000300001
- PubChem. (2018). Acido citrico. Estratto da: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Acido citrico. Estratto da: en.wikipedia.org
- Whitten, K., Davis, R., Peck M. e Stanley, G. (2008). Chimica. (8ava. ed). CENGAGE Apprendimento: Messico.
- Berovic, M. e Legisa, M. (2007). Produzione di acido citrico. Revisione annuale di biotecnologia. Recupero da: researchgate.net



Nessun utente ha ancora commentato questo articolo.