
Formula, proprietà, usi dell'acido clorico (HClO3)
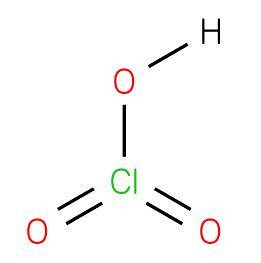
Il acido clorico è un composto inorganico con la formula HClO3, composto da un acido ossacido dove il cloro ha uno stato di ossidazione +5 con una struttura analoga all'acido bromico o all'acido iodico. È un acido forte in grado di donare idrogeno a un accettore o base Bronsted..
L'acido fu scoperto per la prima volta nel 17 ° secolo, da Johann Rudolf Glauber di Karlstadt am Main, in Germania, in cui usò cloruro di sodio e acido solforico per la preparazione del solfato di sodio nel processo di Mannheim, rilasciando gas cloruro dall'idrogeno, dannoso per l'uomo.
Il composto è ottenuto con bario clorato (barite clorato) con acido solforico per produrre bario solfato (Jacob Green, 1829) insolubile in acqua secondo la seguente reazione:
Ba (ClO3)Due + HDueSW4 → 2HClO3 + Baso4
Un altro metodo per ottenere è riscaldando l'acido ipocloroso per ottenere acido clorico e acido cloridrico secondo la reazione:
3HClO → HClO3 + 2HCl
L'acido clorico (HClO3) è un potente ossidante poiché è in grado di essere ridotto agli stati di ossidazione +3, +1 e -1. Viene utilizzato per la produzione di sali di clorato.
Si decompone in concentrazioni superiori al 30%. Si decompone anche se riscaldato, per questo motivo deve essere mantenuto sempre freddo e tutti i barattoli di vetro utilizzati per la manipolazione devono essere preventivamente refrigerati..
Indice articolo
- 1 Proprietà fisiche e chimiche
- 1.1 Autoreattivo
- 2 Reattività e pericoli
- 3 usi
- 4 Riferimenti
Proprietà fisiche e chimiche
L'acido clorico esiste solo in soluzione. È un liquido incolore senza un aroma caratteristico (National Center for Biotechnology Information, 2017), il suo aspetto è mostrato in figura 2.

Il composto ha un peso molecolare di 84,459 g / mol e una densità di 1 g / ml a circa 25 ° C. Ha un punto di ebollizione maggiore di 100 ° C (ACIDO CLORICO, S.F.) e una solubilità in acqua di 40 g per 100 ml di questo solvente a 25 ° C (Royal Society of Chemistry, 2015).
L'acido clorico accelera la combustione dei materiali combustibili e può infiammarsi maggiormente al contatto. Il composto è corrosivo per metalli e tessuti.
Autoreattivo
- Le concentrazioni di acido clorico superiori al 40% si degradano.
- Le soluzioni di solfuro di antimonio e acido clorico concentrato reagiscono con l'incandescenza.
- Le soluzioni di solfuro di arsenico e acido clorico concentrato reagiscono con l'incandescenza.
- Reagisce vigorosamente, esplode anche con altri solfuri metallici, cioè solfuro di rame.
- A contatto con materiali ossidabili, compresa l'ammoniaca, le reazioni possono essere estremamente violente..
- La carta da filtro si accende dopo averla immersa nell'acido cloridrico.
- Le esplosioni sono state registrate da miscele di soluzione di acido clorico con metalli quali: antimonio, bismuto e ferro. Ciò è dovuto alla formazione di composti esplosivi compreso l'idrogeno (ACIDO CLORICO, 2016).
Reattività e rischi
L'acido clorico è un composto instabile. Essendo un acido forte, è estremamente pericoloso in caso di contatto con la pelle (è corrosivo e irritante), a contatto con gli occhi (irritante) e in caso di ingestione. Molto pericoloso anche in caso di inalazione.
Una grave sovraesposizione può causare danni ai polmoni, soffocamento, perdita di conoscenza o morte. L'esposizione prolungata può provocare ustioni e ulcerazioni della pelle.
La sovraesposizione inalatoria può causare irritazione respiratoria. L'infiammazione degli occhi è caratterizzata da arrossamento, lacrimazione e prurito. L'infiammazione della pelle è caratterizzata da prurito, desquamazione, arrossamento e occasionalmente vesciche.
La sostanza è tossica per i reni, i polmoni e le mucose. L'esposizione ripetuta o prolungata alla sostanza può causare danni a questi organi..
In caso di contatto con gli occhi, controllare se si indossano lenti a contatto e rimuoverle immediatamente. Gli occhi devono essere lavati con acqua corrente per almeno 15 minuti, tenendo le palpebre aperte. È possibile utilizzare acqua fredda. Unguento per gli occhi non deve essere utilizzato.
Se la sostanza chimica viene a contatto con gli indumenti, rimuoverla il più rapidamente possibile, proteggendo le mani e il corpo. Metti la vittima sotto una doccia di sicurezza.
Se la sostanza chimica si accumula sulla pelle esposta della vittima, come le mani, la pelle contaminata viene lavata delicatamente e accuratamente con acqua corrente e sapone non abrasivo..
L'acido può anche essere neutralizzato con idrossido di sodio diluito o una base debole come il bicarbonato di sodio. Se l'irritazione persiste, consultare il medico. Lavare gli indumenti contaminati prima di riutilizzarli.
Se il contatto con la pelle è grave, deve essere lavato con un sapone disinfettante e coprire la pelle contaminata con una crema antibatterica..
In caso di inalazione, consentire alla vittima di riposare in un'area ben ventilata. Se l'inalazione è grave, la vittima deve essere evacuata in un'area sicura il prima possibile..
Allenta gli indumenti stretti come il colletto della camicia, la cintura o la cravatta. Se la vittima ha difficoltà a respirare, deve essere somministrato ossigeno. Se la vittima non respira, viene eseguita la rianimazione bocca a bocca.
Sempre tenendo conto che può essere pericoloso per la persona che fornisce aiuto eseguire la rianimazione bocca a bocca, quando il materiale inalato è tossico, infettivo o corrosivo.
In caso di ingestione, non provocare il vomito. Allenta indumenti stretti come colletti di camicie, cinture o cravatte. Se la vittima non respira, eseguire la rianimazione bocca a bocca. In tutti i casi, consultare immediatamente un medico..
Applicazioni
L'acido clorico è utilizzato principalmente per la formazione di sali clorato come: sodio, calcio, magnesio, stronzio, piombo, rame e argento clorato nonché protoclor e perclorato di mercurio vengono preparati utilizzando acido clorico come reagente..
Precursore stabile del biossido di cloro, viene utilizzato nella produzione elettrochimica di perclorato di ammonio ad elevata purezza (Dotson, 1993).
La principale produzione di acido clorico è iniziata durante la rivoluzione industriale in Europa ed è stata utilizzata per produrre cloruro di vinile per tubi in PVC.
Un altro uso dell'acido è rappresentato da numerose applicazioni su scala ridotta, tra cui la pulizia domestica, la produzione di gelatina e altri additivi alimentari, la disincrostazione e la lavorazione della pelle (acido clorico, S.F.).
Riferimenti
- ACIDO CLORICO. (2016). Estratto da cameochemicals: cameochemicals.noaa.gov.
- acido clorico. (S.F.). Recuperato da weebly: http://chloricacid.weebly.com/
- ACIDO CLORICO. (S.F.). Estratto da chemicalbook: chemicalbook.com.
- Dotson, R. (1993). Un nuovo processo elettrochimico per la produzione di perclorato di ammonio. Journal of Applied Electrochemistry Volume 23, Edizione 9,, 897-904. link.springer.com.
- EMBL-EBI. (2014, 28 luglio). acido clorico. Recupero da ebi.ac.uk: ebi.ac.uk.
- Jacob Green, E. T. (1829). Un libro di testo di filosofia chimica . Philadelphia: Russell e Martien.
- National Center for Biotechnology Information ... (2017, 15 aprile). Database composto di PubChem; CID = 19654. Recupero da pubchem: .pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). ACIDO CLORICO. Estratto da chemspider: chemspider.com.



Nessun utente ha ancora commentato questo articolo.