
Struttura, proprietà, usi e rischi del ciclopropano (C3H6)

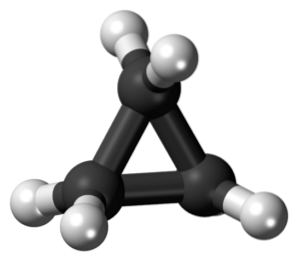
Il ciclopropano è una molecola ciclica che ha la formula molecolare C3H6, e costituito da tre atomi di carbonio legati insieme sotto forma di un anello. In chimica esiste una famiglia di idrocarburi saturi che hanno uno scheletro costituito da atomi di carbonio uniti da singoli legami a forma di anello..
Questa famiglia è composta da un numero variabile di molecole (che differiscono per la lunghezza della loro catena di carbonio principale) e sono note per avere punti di fusione e di ebollizione più elevati di quelli delle catene alte, nonché una reattività maggiore di queste..
Il ciclopropano fu scoperto nel 1881 da un chimico austriaco di nome August Freund, che era determinato a sapere quale fosse l'elemento tossico nell'etilene e che arrivò a pensare che fosse lo stesso ciclopropano.
Anche così, fu solo negli anni '30 che iniziò a essere prodotto a livello industriale, quando scoprirono i suoi usi come anestesia, perché prima di allora non lo trovavano attrattiva commerciale.
Indice articolo
- 1 Struttura chimica
- 2 Proprietà
- 2.1 Punto di ebollizione
- 2.2 Punto di fusione
- 2.3 Densità
- 2.4 Reattività
- 3 usi
- 4 Rischi
- 5 Riferimenti
Struttura chimica
Ciclopropano, di formula molecolare C3H6, Consiste di tre piccoli atomi di carbonio che si uniscono in una configurazione tale da formare un anello, lasciando una simmetria molecolare di D3h su ogni carbonio della catena.
La struttura di questa molecola richiede che gli angoli di legame che si formano siano di circa 60º, molto meno dei 109,5º che si osservano tra gli atomi ibridi sp.3, che è un angolo più termodinamicamente stabile.
Questo fa sì che l'anello soffra di uno stress strutturale più significativo rispetto ad altre strutture di questo tipo, oltre ad uno stress torsionale naturale che possiede per la conformazione eclissata dei suoi atomi di idrogeno..
Per questo stesso motivo, i legami che si formano tra gli atomi di carbonio in questa molecola sono notevolmente più deboli che nei comuni alcani..
In modo peculiare ea differenza di altri legami dove la vicinanza tra due molecole simboleggia una maggiore energia di legame, i legami tra i carboni di questa molecola hanno la particolarità di avere una lunghezza minore rispetto agli altri alcani (per la loro geometria), e allo stesso tempo sono più deboli delle unioni tra di loro.
Inoltre, il ciclopropano possiede la stabilità per delocalizzazione ciclica dei sei elettroni nei legami carbonio-carbonio, essendo leggermente più instabile del ciclobutano e notevolmente più del cicloesano..
Proprietà
Punto di ebollizione
Rispetto agli altri cicloalcani più comuni, il ciclopropano ha il punto di ebollizione più basso tra questi tipi di molecole, voltatilizzandosi a 33 gradi sotto zero (nessun altro cicloalcano volatilizzano a temperature inferiori allo zero).
Rispetto al propano lineare, invece, il ciclopropano ha un punto di ebollizione più alto: volatilizza a 42 ° C sotto zero, leggermente inferiore a quello del suo cugino cicloalcano.
Punto di fusione
Il punto di fusione del ciclopropano è inferiore a quello di altri cicloalcani, fondendosi a una temperatura di 128 ºC inferiore a zero. Anche così, non è l'unico cicloalcano che fonde a una temperatura inferiore allo zero, e questo fenomeno può essere osservato anche in ciclobutano, ciclopentano e cicloeptano..
Quindi, nel caso del propano lineare, fonde a una temperatura inferiore a 187 ° C sotto lo zero..
Densità
Il ciclopropano ha la densità più alta tra i cicloalcani, essendo più di due volte superiore al cicloalcano comune più denso (1,879 g / l per il ciclopropano, superando il ciclodecano con 0,871).
Una densità maggiore si osserva anche nel ciclopropano rispetto al propano lineare. La differenza nei punti di ebollizione e fusione tra alcani lineari e cicloalcani è dovuta alle maggiori forze di Londra, che sono aumentate dalla forma dell'anello che consente una maggiore area di contatto tra gli atomi interni..
Reattività
La reattività della molecola di ciclopropano è direttamente influenzata dalla debolezza dei suoi legami, aumentando notevolmente rispetto ad altri cicloalcani per effetto della tensione esercitata su questi legami..
Grazie a ciò, il ciclopropano può essere separato più facilmente e può comportarsi come un alchene in determinate reazioni. Infatti, l'estrema reattività delle miscele ciclopropano-ossigeno può diventare un pericolo di esplosione..
Applicazioni
L'uso commerciale del ciclopropano per eccellenza è come agente anestetico, studiando questa proprietà per la prima volta nel 1929.
Il ciclopropano è un potente agente anestetico ad azione rapida che non irrita le vie aeree né ha un cattivo odore. È stato usato per diversi decenni insieme all'ossigeno per addormentare i pazienti durante l'intervento chirurgico, ma si cominciarono a osservare effetti collaterali indesiderati, rappresentati come "shock da ciclopropano"..
Insieme al costo e ai fattori di elevata infiammabilità, è stato sottoposto a un processo di eliminazione e sostituzione con altri agenti anestetici più sicuri..
Sebbene abbia continuato a far parte dei composti utilizzati nell'induzione dell'anestesia, oggi non fa parte degli agenti utilizzati nelle applicazioni mediche.
Rischi
- Il ciclopropano è un gas altamente infiammabile, che produce gas tossici quando viene a contatto con una fiamma. Inoltre, può reagire con agenti ossidanti come perclorati, perossidi, permanganati, nitrati e alogeni, provocando incendi e / o esplosioni..
- Alti livelli di ciclopropano possono causare mal di testa, vertigini, nausea, perdita di coordinazione, sensazione di svenimento e / o stordimento..
- Può anche portare a irregolarità del ritmo cardiaco o aritmia, difficoltà respiratorie, coma e persino la morte..
- Il ciclopropano liquefatto può causare congelamento sulla pelle a causa della sua temperatura notevolmente inferiore allo zero.
- Poiché è un gas in condizioni ambientali, questo composto può facilmente entrare nel corpo attraverso l'aria e riduce anche il livello di ossigeno nell'aria..
Riferimenti
- Britannica, E. (s.f.). Ciclopropano. Estratto da britannica.com
- Chimica, O. (s.f.). Sintesi di ciclopropano. Recupero da organic-chemistry.org
- ChemSpider. (s.f.). Ciclopropano. Estratto da chemspider.com
- Wagnières, O. (s.f.). Prodotti naturali contenenti ciclopropano. Recupero da lspn.epfl.ch
- Wikipedia. (s.f.). Ciclopropano. Estratto da en.wikipedia.org


Nessun utente ha ancora commentato questo articolo.