
Struttura, proprietà, rischi, usi del cianuro di sodio (NaCN)

Il Cianuro di sodio è un sale inorganico formato da un catione di sodio Na+ e un anione cianuro CN-. La sua formula chimica è NaCN. Conosciuto anche come cianuro di sodio, è un solido cristallino bianco. È igroscopico, cioè assorbe l'acqua dall'ambiente ei suoi cristalli sono cubici come il cloruro di sodio NaCl.
Quando sciolto in acqua tende a formare acido cianidrico HCN. Le sue soluzioni dissolvono facilmente l'oro e l'argento. Questa caratteristica lo rende utilizzato per estrarre oro e argento dai suoi minerali. Le soluzioni utilizzate per questo scopo vengono riciclate, ovvero vengono riutilizzate più volte.

Tuttavia, parte del cianuro riesce a fuggire in alcuni laghetti di scarico, che rappresenta un pericolo per la fauna selvatica e per l'uomo, poiché il cianuro è molto tossico e può causare la morte..
Il NaCN viene utilizzato nell'industria chimica come intermedio per preparare vari tipi di composti, come coloranti, prodotti chimici per l'agricoltura e farmaci o medicinali..
Il cianuro di sodio è un composto molto pericoloso in quanto può causare la morte, quindi deve essere maneggiato con estrema cautela.
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Punto di ebollizione
- 3.5 Punto di infiammabilità
- 3.6 Densità
- 3.7 Solubilità
- 3.8 Costante di dissociazione
- 3,9 pH
- 3.10 Proprietà chimiche
- 4 Rischi
- 5 Ottenimento
- 6 Usi
- 6.1 Nell'estrazione di minerali d'oro e d'argento. Conseguenze
- 6.2 Nella produzione di altri composti chimici
- 6.3 Nell'industria metallurgica
- 6.4 In altri usi
- 6.5 Applicazioni fuori uso, in dubbio o molto rare
- 7 Riferimenti
Struttura
Il cianuro di sodio è costituito da uno ione Na + e uno ione CN-.
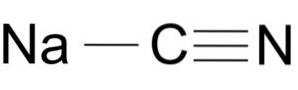
Lo ione cianuro ha un atomo di carbonio C e un atomo di azoto N legati tra loro da un triplo legame..
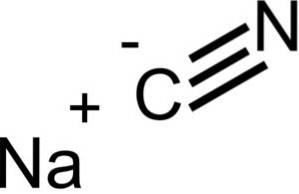
NaCN ha la stessa struttura cristallina di NaCl, quindi i suoi cristalli sono cubici.
Nomenclatura
-Cianuro di sodio
-Cianuro di sodio
Proprietà
Stato fisico
Solido cristallino bianco igroscopico (assorbe l'acqua dall'ambiente).
Peso molecolare
49,007 g / mol
Punto di fusione
563,7 ºC
Punto di ebollizione
1496 ºC
Punto d'infiammabilità
Non è infiammabile. Ma se esposti a un incendio, vengono prodotti acido cianidrico HCN e ossidi di azoto..
Densità
1.595 g / cm3 a 20 ºC
Solubilità
Molto solubile in acqua: 48 g / 100 mL a 10ºC, 82 g / 100 mL a 35ºC. Leggermente solubile in alcool
Costante di dissociazione
Viene idrolizzato in soluzione acquosa generando acido cianidrico HCN. La costante di questa idrolisi è Kh = 2,5 x 10-5.
pH
Le soluzioni acquose di NaCN sono fortemente alcaline
Proprietà chimiche
Una volta sciolto in acqua, si separa nei suoi ioni Na+ e CN-. In soluzione acquosa lo ione cianuro CN- prendi un protone H+ di acqua HDueO formando HCN e uno ione OH-, quindi la soluzione diventa alcalina.
CN- + HDueO → HCN + OH-
Per questo motivo, le sue soluzioni acquose si decompongono rapidamente quando vengono immagazzinate, formando acido cianidrico HCN..
È corrosivo nei confronti dell'alluminio. Le sue soluzioni dissolvono facilmente l'oro Au e l'argento Ag in presenza di aria..
È un agente chelante poiché l'anione cianuro CN- può legarsi facilmente ad altri metalli, come argento, oro, mercurio, zinco, cadmio, ecc..
Ha un debole odore di mandorla amara.
Rischi
Deve essere maneggiato con grande cura. È un composto altamente velenoso, inibisce importanti processi metabolici e porta alla morte per ingestione, inalazione, assorbimento attraverso la pelle o contatto con gli occhi..
Se inalato, NaCN si dissolve nella mucosa delle vie respiratorie e passa nel flusso sanguigno. Lo ione cianuro di NaCN ha una forte affinità per il ferro nello stato di ossidazione di +3, cioè il catione ferrico Fe3+.
Quando il cianuro viene assorbito, reagisce rapidamente con Fe3+ di un importante enzima dei mitocondri delle cellule (citocromo ossidasi), prevenendo alcuni processi della respirazione di questo.
Pertanto, la respirazione cellulare viene inibita o rallentata e ne risulta ipossia citotossica. Significa che cellule e tessuti non sono in grado di utilizzare l'ossigeno, soprattutto le cellule cerebrali e cardiache.
In questo modo si verificano danni permanenti o letali al corpo. Ciò può verificarsi sia negli esseri umani che negli animali..
Se ingerito, provoca la congestione dei vasi sanguigni e la corrosione della mucosa gastrica, oltre al suddetto.

Non è combustibile, ma a contatto con acidi rilascia HCN che è altamente infiammabile e tossico.
Se si scioglie con nitriti o clorati può esplodere.
Ottenere
Può essere ottenuto con sodio Na, ammoniaca NH3 e carbonio C. Il sodio reagisce con l'ammoniaca per dare l'ammide di sodio NaNHDue:
2 Na + 2 NH3 → 2 NaNHDue + HDue↑
La sodio ammide viene riscaldata con carbone a 600 ° C e produce sodio cianammide NaDueNCN, che viene poi convertito in cianuro di sodio con carbone di legna a 800 ºC:
2 NaNHDue + C → 2 HDue↑ + NaDueNCN
N / ADueNCN + C → 2 NaCN
Un altro metodo consiste nello sciogliere la calciocianammide CaNCN e il carbonio C con il carbonato di sodio NaDueCO3:
CaNCN + C + NaDueCO3 → CaCO3 + 2 NaCN
Può anche essere preparato passando il gas azoto NDue da una miscela calda di carbonato di sodio NaDueCO3 e carbonio C in polvere, utilizzando ferro Fe come catalizzatore o acceleratore di reazione:
N / ADueCO3 + 4 C + NDue → 2 NaCN + 3 CO ↑
Applicazioni
Nell'estrazione di minerali d'oro e d'argento. Conseguenze
Il cianuro di sodio è stato a lungo utilizzato per estrarre i metalli oro e argento dai loro minerali..
Il cianuro utilizzato nel processo viene riciclato, ma qualcosa fuoriesce nello stagno dei rifiuti insieme ai metalli pesanti non recuperati.
Uccelli, pipistrelli e altri animali che bevono da queste lagune di cianuro sono stati avvelenati.
Ci sono registrazioni di una diga in Romania che ha isolato uno stagno di rifiuti ed è stata danneggiata da un evento meteorologico..
Di conseguenza, tonnellate di cianuro furono rilasciate nel fiume Sasar e nei sistemi acquiferi vicini come i fiumi Lapus, Somes e Tisza, terminando nel Danubio..
Ciò ha causato una cascata di morti di animali o, in altre parole, un disastro ecologico..

Nella produzione di altri composti chimici
Il cianuro di sodio NaCN viene utilizzato nella sintesi di vari tipi di composti organici.
Ad esempio, vengono preparati pigmenti e coloranti (inclusi sbiancanti ottici), composti da utilizzare in agricoltura o prodotti chimici per l'agricoltura e vari prodotti farmaceutici..
Viene anche utilizzato per ottenere agenti chelanti o sequestranti per ioni metallici..
I composti chiamati nitrili sono preparati con cianuro di sodio NaCN, che se trattato con una soluzione acquosa acida o alcalina calda consente di ottenere acidi carbossilici.
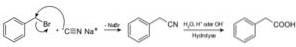
Permette di preparare acidi grassi con gruppi ciano, cianuri di metalli pesanti e acido cianidrico o acido cianidrico HCN.
Nell'industria metallurgica
NaCN è utilizzato in soluzioni utilizzate nella galvanica o galvanica di metalli (rivestimento di metalli con altri), ad esempio zinco.
È un componente di acciaio temprato. Serve anche nella pulizia dei metalli.
In altri usi
Il cianuro di sodio è un intermedio nella produzione di nylon.
Serve per la separazione dei minerali mediante flottazione con schiuma.
Applicazioni fuori uso, in discussione o molto rare
NaCN è stato utilizzato per uccidere roditori, come conigli e ratti, e le loro tane, e per uccidere i nidi di termiti.
Attualmente viene utilizzato saltuariamente per eliminare coyote, volpi e cani selvatici. Utilizzato sotto forma di capsule in dosi singole o multiple su pascoli, terreni di caccia e foreste.
A causa della sua estrema tossicità, NaCN deve essere utilizzato solo da persone addestrate..
Questo uso è considerato molto pericoloso per l'uomo, ma c'è chi lo usa ancora.

In agricoltura era anticamente utilizzato per la fumigazione di alberi di agrumi e altri frutti. Veniva utilizzato anche come insetticida e miticida (eliminatore di acari) da applicare dopo la raccolta, per gli agrumi non stoccati o per la fumigazione dei camion utilizzati per il loro trasporto. Era anche usato per fumigare navi, vagoni ferroviari e magazzini..
Tutti questi usi sono stati messi in dubbio a causa dell'elevata tossicità del cianuro di sodio. Per questo motivo non viene più utilizzato o solo molto raramente e in condizioni molto controllate..
Riferimenti
- NOI. Biblioteca nazionale di medicina. (2019). Cianuro di sodio. Recupero da pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Quarta edizione. John Wiley & Sons.
- Hurst, H.E. e Martin, M.D. (2017). Tossicologia. Cianuro. In Pharmacology and Therapeutics for Dentistry (Settima Edizione). Recupero da sciencedirect.com.
- Coppock, R.W. e Dziwenka, M. (2015). Minacce alla fauna selvatica da parte di agenti di guerra chimica. In Handbook of Toxicology of Chemical Warfare Agents (seconda edizione). Recupero da sciencedirect.com.
- Morrison, R.T. e Boyd, R.N. (2002). Chimica organica. 6a edizione. Prentice-Hall.


Nessun utente ha ancora commentato questo articolo.