
CHON caratteristiche comuni, peculiarità e molecole
CHON: Il carbonio C, l'idrogeno H, l'ossigeno O e l'azoto N, sono un gruppo di elementi chimici che compongono la materia vivente. A causa della loro posizione nella tavola periodica, questi atomi condividono caratteristiche che li rendono adatti a formare molecole organiche e covalenti..
Questi quattro elementi chimici costituiscono la maggior parte delle molecole degli esseri viventi, chiamati bioelementi o elementi biogenici. Appartengono al gruppo dei bioelementi primari o principali perché sono per il 95% nelle molecole degli esseri viventi.
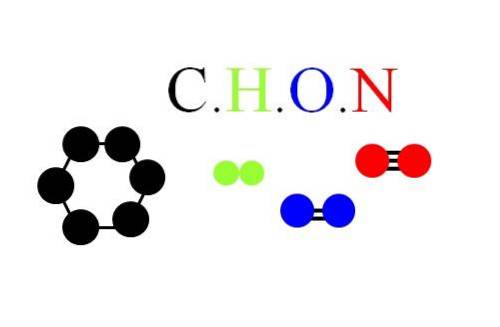
Le molecole e gli atomi di CHON sono mostrati nell'immagine in alto: un anello esagonale come unità molecolare nel carbonio; la molecola H.Due (Colore verde); la molecola biatomica di ODue (il colore blu); e la molecola biatomica di NDue (colorato in rosso), con il suo triplo legame.
Hanno, oltre alle proprietà comuni, alcune peculiarità o caratteristiche che spiegano perché sono adatte a formare biomolecole. Avendo un basso peso atomico o massa, questo li rende molto elettronegativi e formano legami covalenti stabili, forti e ad alta energia..
Si legano insieme formando parte della struttura delle biomolecole organiche come proteine, carboidrati, lipidi e acidi nucleici. Partecipano anche alla formazione di molecole inorganiche essenziali per l'esistenza della vita; come l'acqua, H.DueO.
Indice articolo
- 1 Caratteristiche comuni di CHON
- 1.1 Massa atomica bassa
- 1.2 Elevata elettronegatività
- 2 Caratteristiche speciali
- 2.1 L'atomo di carbonio C
- 2.2 L'atomo di H.
- 2.3 L'atomo di O
- 2.4 L'atomo di azoto
- 3 Molecole che compongono CHON
- 3.1 acqua
- 3.2 I gas
- 3.3 Biomolecole
- 4 Riferimenti
Caratteristiche comuni di CHON
Bassa massa atomica
Hanno una massa atomica bassa. Le masse atomiche di C, H, O e N sono: 12u, 1u, 16u e 14u. Ciò fa sì che abbiano un raggio atomico più piccolo, che a sua volta consente loro di stabilire legami covalenti stabili e forti..
I legami covalenti si formano quando gli atomi che partecipano alla formazione delle molecole condividono i loro elettroni di valenza..
Avere una massa atomica bassa, e quindi un raggio atomico inferiore, rende questi atomi molto elettronegativi.
Elevata elettronegatività
C, H, O e N sono molto elettronegativi: attraggono fortemente gli elettroni che condividono quando formano legami all'interno di una molecola.
Tutte le proprietà comuni descritte per questi elementi chimici sono favorevoli alla stabilità e alla forza dei legami covalenti che formano..
I legami covalenti che formano possono essere apolari, quando gli stessi elementi si uniscono, formando molecole biatomiche come ODue. Possono anche essere polari (o relativamente polari) quando uno degli atomi è più elettronegativo dell'altro, come nel caso di O rispetto a H.
Questi elementi chimici hanno un movimento tra gli esseri viventi e l'ambiente noto come ciclo biogeochimico in natura..
Caratteristiche speciali
Di seguito vengono citate alcune particolarità o proprietà che ciascuno di questi elementi chimici possiede che danno ragione alla sua funzione strutturale di biomolecole.
L'atomo di carbonio C
-A causa della sua tetravalenza, il C può formare 4 legami con 4 elementi diversi o uguali, formando una grande varietà di molecole organiche.
-Può essere attaccato ad altri atomi di carbonio formando lunghe catene, che possono essere lineari o ramificate.
-Può anche formare molecole cicliche o chiuse.
-Può formare molecole con legami singoli, doppi o tripli. Se nella struttura oltre a C è presente H puro, allora si parla di idrocarburi: rispettivamente alcani, alcheni e alchini.
-Unendosi con O, o N, il legame acquisisce polarità, che facilita la solubilità delle molecole che ha origine..
-Quando combinato con altri atomi come O, H e N, forma diverse famiglie di molecole organiche. Può formare aldeidi, chetoni, alcoli, acidi carbossilici, ammine, eteri, esteri, tra gli altri composti.
-Le molecole organiche avranno una conformazione spaziale diversa, che sarà correlata alla funzionalità o all'attività biologica..
L'atomo H.
-Ha il numero atomico più basso di tutti gli elementi chimici e si combina con O per formare l'acqua.
-Questo atomo di H è presente in gran parte negli scheletri di carbonio che formano molecole organiche..
-Maggiore è il numero di legami C-H nelle biomolecole, maggiore è l'energia prodotta dalla loro ossidazione. Per questo motivo l'ossidazione degli acidi grassi genera più energia di quella prodotta nel catabolismo dei carboidrati..
L'atomo di O
È il bioelemento che insieme all'H compongono l'acqua. L'ossigeno è più elettronegativo dell'idrogeno, il che gli consente di formare dipoli nella molecola d'acqua..
Questi dipoli facilitano la formazione di forti interazioni, chiamate legami idrogeno. I legami deboli come i ponti H sono essenziali per la solubilità molecolare e per il mantenimento della struttura delle biomolecole..
L'atomo di azoto
-Si trova nel gruppo amminico degli amminoacidi e nel gruppo variabile di alcuni amminoacidi come l'istidina, tra gli altri.
-È essenziale per la formazione di ammino zuccheri, basi azotate di nucleotidi, coenzimi, tra le altre molecole organiche.
Molecole che compongono CHON
acqua

H e O sono uniti da legami covalenti, formando acqua in un rapporto di 2H e O. Poiché l'ossigeno è più elettronegativo dell'idrogeno, si uniscono formando un legame covalente di tipo polare..
Avendo questo tipo di legame covalente, consente a molte sostanze di essere solubili formando legami idrogeno con esse. L'acqua fa parte della struttura di un organismo o essere vivente in circa il 70-80%.
L'acqua è il solvente universale, svolge molte funzioni nella natura e negli esseri viventi; ha funzioni strutturali, metaboliche e regolatorie. In mezzo acquoso, la maggior parte delle reazioni chimiche degli esseri viventi viene eseguita, tra molte altre funzioni..
I gas

Per unione del tipo covalente apolare, cioè senza differenza di elettronegatività, si uniscono atomi uguali come O. Si formano così i gas atmosferici, come l'azoto e l'ossigeno molecolare, essenziali per l'ambiente e gli esseri viventi..
Biomolecole

Questi bioelementi si uniscono tra loro e con altri bioelementi, formando le molecole degli esseri viventi.
Sono uniti da legami covalenti, dando origine a unità monomeriche o semplici molecole organiche. Questi a loro volta sono uniti da legami covalenti e formano polimeri o molecole organiche complesse e supramolecole..
Pertanto, gli amminoacidi formano le proteine ei monosaccaridi sono le unità strutturali dei carboidrati o dei carboidrati. Gli acidi grassi e il glicerolo costituiscono i lipidi saponificabili, mentre i mononucleotidi costituiscono gli acidi nucleici DNA e RNA.
Tra le supramolecole ci sono, ad esempio: glicolipidi, fosfolipidi, glicoproteine, lipoproteine, tra gli altri.
Riferimenti
- Carey F. (2006). Chimica organica. (6a ed.). Messico, Mc Graw Hill.
- Eroe del corso. (2018). 2 funzione dei bioelementi bioelementi primari tra. Estratto da: coursehero.com
- Cronodon. (s.f.). Bioelementi. Recupero da: cronodon.com
- Persona di vita. (2018). Bioelementi: classificazione (primaria e secondaria). Estratto da: lifepersona.com
- Mathews, Holde e Ahern. (2002). Biochimica (3a ed.). Madrid: PEARSON


Nessun utente ha ancora commentato questo articolo.