
Qual è il calore di reazione?

Il calore di reazione o Entalpia di reazione (ΔH) è la variazione di entalpia di una reazione chimica che si verifica a pressione costante. È un'unità di misura termodinamica utile per calcolare la quantità di energia per mole che viene rilasciata o prodotta in una reazione.
Poiché l'entalpia deriva dalla pressione, dal volume e dall'energia interna, che sono tutte funzioni di stato, anche l'entalpia è una funzione di stato..
ΔH, ovvero la variazione di entalpia emersa come unità di misura intesa a calcolare la variazione di energia di un sistema quando diventava troppo difficile trovare la ΔU, ovvero la variazione di energia interna di un sistema, misurando contemporaneamente la quantità di calore e di lavoro scambiati.
Data una pressione costante, la variazione di entalpia è uguale al calore e può essere misurata come ΔH = q.
La notazione ΔHº o ΔHºr quindi nasce per spiegare la temperatura e la pressione precise del calore di reazione ΔH.
L'entalpia standard di reazione è simbolizzata da ΔHº o ΔHºrxn e può assumere valori sia positivi che negativi. Le unità di ΔHº sono kiloJoules per mole o kj / mol.
Concetto precedente per comprendere il calore di reazione: differenze tra ΔH e ΔHºr.
Δ = rappresenta la variazione di entalpia (entalpia dei prodotti meno entalpia dei reagenti).
Un valore positivo indica che i prodotti hanno una maggiore entalpia o che si tratta di una reazione endotermica (è richiesto calore).
Un valore negativo indica che i reagenti hanno una maggiore entalpia o che si tratta di una reazione esotermica (viene prodotto calore).
º = significa che la reazione è una variazione di entalpia standard e si verifica a una pressione / temperatura preimpostata.
r = denota che questo cambiamento è l'entalpia della reazione.
Lo stato standard: lo stato standard di un solido o liquido è la sostanza pura alla pressione di 1 bar o qual è la stessa atmosfera (105 Pa) e una temperatura di 25 ° C, o qual è la stessa 298 K.
Il ΔHºr è il calore di reazione standard o l'entalpia standard di una reazione e, come ΔH, misura anche l'entalpia di una reazione. Tuttavia, ΔHºrxn avviene in condizioni “standard”, il che significa che la reazione avviene a 25 ° C e 1 atm..
Il vantaggio di una misurazione ΔH in condizioni standard risiede nella capacità di mettere in relazione un valore ΔHº con un altro, poiché si verificano nelle stesse condizioni.
Calore di formazione
Il calore standard di formazione, ΔHFº, di un prodotto chimico è la quantità di calore assorbita o rilasciata dalla formazione di 1 mole di quella sostanza chimica a 25 gradi Celsius e 1 bar dei suoi elementi nei loro stati standard.
Un elemento è nel suo stato standard se è nella sua forma più stabile e nel suo stato fisico (solido, liquido o gassoso) a 25 gradi Celsius e 1 bar.
Ad esempio, il calore standard di formazione dell'anidride carbonica coinvolge ossigeno e carbonio come reagenti..
L'ossigeno è più stabile delle molecole di gas O.Due, mentre il carbonio è più stabile della grafite solida. (La grafite è più stabile del diamante in condizioni standard).
Per esprimere la definizione in un altro modo, il calore standard di formazione è un tipo speciale di calore standard di reazione..
La reazione è la formazione di 1 mole di una sostanza chimica dai suoi elementi nei loro stati standard in condizioni standard.
Il calore standard di formazione è anche chiamato entalpia standard di formazione (sebbene in realtà sia un cambiamento di entalpia).
Per definizione, la formazione di un elemento di per sé non produrrebbe alcun cambiamento di entalpia, quindi il calore standard di reazione per tutti gli elementi è zero (Cai, 2014).
Calcolo dell'entalpia di reazione
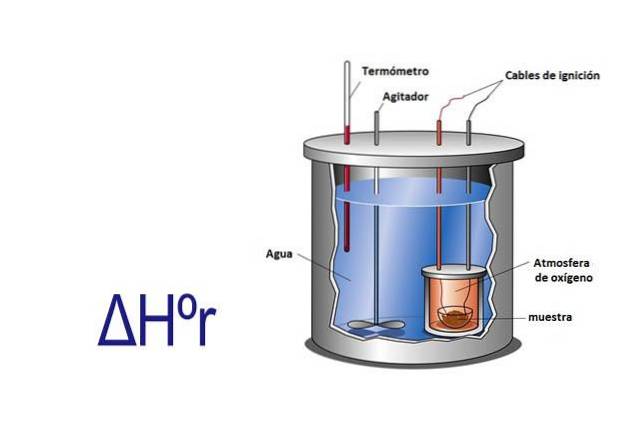
1- Calcolo sperimentale
L'entalpia può essere misurata sperimentalmente utilizzando un calorimetro. Un calorimetro è uno strumento in cui un campione viene fatto reagire attraverso cavi elettrici che forniscono l'energia di attivazione. Il campione si trova in un contenitore circondato da acqua che viene costantemente agitata.
Misurando con a la variazione di temperatura che avviene quando il campione reagisce, e conoscendo il calore specifico dell'acqua e la sua massa, si calcola il calore rilasciato o assorbito dalla reazione utilizzando l'equazione q = Cesp x m x ΔT.
In questa equazione q è il calore, Cesp è il calore specifico in questo caso dell'acqua che è uguale a 1 caloria per grammo, m è la massa dell'acqua e ΔT è il cambiamento di temperatura.
Il calorimetro è un sistema isolato che ha una pressione costante, quindi ΔHr= q
2- Calcolo teorico
La variazione di entalpia non dipende dal particolare percorso di una reazione, ma solo dal livello energetico globale dei prodotti e dei reagenti. L'entalpia è una funzione di stato e come tale è additiva.
Per calcolare l'entalpia standard di una reazione, possiamo sommare le entalpie standard di formazione dei reagenti e sottrarle dalla somma delle entalpie standard di formazione dei prodotti (Boundless, S.F.). Detto matematicamente, questo ci dà:
ΔHr° = Σ ΔHFº (prodotti) - Σ ΔHFº (reagenti).
Le entalpie delle reazioni vengono solitamente calcolate dalle entalpie della formazione dei reagenti in condizioni normali (pressione di 1 bar e temperatura di 25 gradi Celsius).
Per spiegare questo principio della termodinamica, calcoleremo l'entalpia della reazione per la combustione del metano (CH4) secondo la formula:
CH4 (g) + 2ODue (g) → CODue (g) + 2HDueO (g)
Per calcolare l'entalpia standard della reazione, dobbiamo trovare le entalpie standard di formazione per ciascuno dei reagenti e dei prodotti coinvolti nella reazione..
Di solito si trovano in un'appendice o in varie tabelle online. Per questa reazione, i dati di cui abbiamo bisogno sono:
HFº CH4 (g) = -75 kjoul / mol.
HFº ODue (g) = 0 kjoul / mol.
HFº CODue (g) = -394 kjoul / mol.
HFº HDueO (g) = -284 kjoul / mol.
Si noti che, poiché è nel suo stato standard, l'entalpia standard di formazione per l'ossigeno gassoso è 0 kJ / mol.
Qui riassumiamo le nostre entalpie di formazione standard. Si noti che poiché le unità sono in kJ / mol, è necessario moltiplicare per i coefficienti stechiometrici nell'equazione di reazione bilanciata (Leaf Group Ltd, S.F.).
Σ ΔHFº (prodotti) = ΔHFº CODue +2 ΔHFº HDueO
Σ ΔHFº (prodotti) = -1 (394 kjoul / mol) -2 (284 kjoul / mol) = -962 kjoul / mol
Σ ΔHFº (reagenti) = ΔHFº CH4 + ΔHFº ODue
Σ ΔHFº (reagenti) = -75 kjoul / mol + 2 (0 kjoul / mol) = -75 kjoul / mol
Ora possiamo trovare l'entalpia standard della reazione:
ΔHr° = Σ ΔHFº (prodotti) - Σ ΔHFº (reagenti) = (- 962) - (- 75) =
ΔHr° = - 887kJ / mol.
Riferimenti
- Anne Marie Helmenstine. (2014, 11 giugno). Definizione di entalpia di reazione. Recupero da thoughtco: thoughtco.com.
- (S.F.). Entalpia standard di reazione. Recuperato da boundless: boundless.com.
- Cai, E. (2014, 11 marzo). calore standard di formazione. Recupero da chemicalstatistician: chemicalstatistician.wordpress.com.
- Clark, J. (2013, maggio). Diverse definizioni di modifica dell'entalpia. Estratto da chemguide.co.uk: chemguide.co.uk.
- Jonathan Nguyen, G. L. (2017, 9 febbraio). Entalpia standard di formazione. Recupero da chem.libretexts.org: chem.libretexts.org.
- Leaf Group Ltd. (S.F.). Come calcolare le entalpie di reazione. Recupero da sciencing: sciencing.com.
- Rachel Martin, E. Y. (2014, 7 maggio). Calore di reazione. Recupero da chem.libretexts.org: chem.libretexts.org.



Nessun utente ha ancora commentato questo articolo.