
Concetto di carica nucleare efficace, come calcolarlo ed esempi
Il carica nucleare efficace (Zef) è la forza di attrazione esercitata dal nucleo su uno qualsiasi degli elettroni dopo essere stato ridotto dagli effetti della schermatura e della penetrazione. Se non ci fossero tali effetti, gli elettroni sentirebbero la forza attrattiva della carica nucleare reale Z.
Nell'immagine sotto abbiamo il modello atomico di Bohr per un atomo fittizio. Il suo nucleo ha una carica nucleare Z = + n, che attrae gli elettroni che gli orbitano attorno (i cerchi blu). Si può vedere che due elettroni sono in un'orbita più vicina al nucleo, mentre il terzo elettrone si trova a una distanza maggiore da esso..
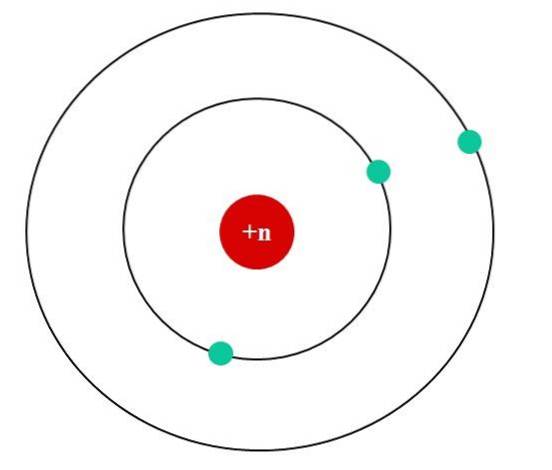
Il terzo elettrone orbita percependo le repulsioni elettrostatiche degli altri due elettroni, quindi il nucleo lo attrae con meno forza; cioè, l'interazione nucleo-elettrone diminuisce come risultato della schermatura dei primi due elettroni.
Quindi i primi due elettroni sentono la forza attrattiva di una carica a + n, ma il terzo sperimenta invece una carica nucleare efficace di + (n-2)..
Tuttavia, detto Zef sarebbe valido solo se le distanze (il raggio) dal nucleo di tutti gli elettroni fossero sempre costanti e definite, localizzando le loro cariche negative (-1).
Indice articolo
- 1 Concetto
- 1.1 Penetrazione e effetti di schermatura
- 2 Come calcolarlo?
- 2.1 Regola di Slater
- 3 esempi
- 3.1 Determina Zef per gli elettroni nell'orbitale 2s2 del berillio
- 3.2 Determina Zef per gli elettroni nell'orbitale 3p3 del fosforo
- 4 Riferimenti
Concetto
I protoni definiscono i nuclei degli elementi chimici e gli elettroni definiscono la loro identità all'interno di un insieme di caratteristiche (i gruppi della tavola periodica)..
I protoni aumentano la carica nucleare Z alla velocità di n + 1, che viene compensata dall'aggiunta di un nuovo elettrone per stabilizzare l'atomo.
All'aumentare del numero di protoni, il nucleo viene “ricoperto” da una nube dinamica di elettroni, in cui le regioni attraverso le quali circolano sono definite dalle distribuzioni di probabilità delle parti radiali e angolari delle funzioni d'onda (gli orbitali).
Da questo approccio, gli elettroni non orbitano in una regione definita dello spazio attorno al nucleo, ma piuttosto, come le pale di una ventola in rapida rotazione, si sfocano nelle forme degli orbitali noti s, p, de f.
Per questo motivo, la carica negativa -1 di un elettrone è distribuita da quelle regioni in cui penetrano gli orbitali; maggiore è l'effetto penetrante, maggiore è la carica nucleare effettiva che detto elettrone sperimenterà nell'orbitale.
Effetti di penetrazione e schermatura
Secondo la spiegazione sopra, gli elettroni nei gusci interni non contribuiscono con una carica -1 alla repulsione stabilizzante degli elettroni nei gusci esterni..
Tuttavia, questo kernel (i gusci precedentemente riempiti dagli elettroni) funge da "muro" che impedisce alla forza di attrazione del nucleo di raggiungere gli elettroni esterni..
Questo è noto come effetto schermo o effetto di schermatura. Inoltre, non tutti gli elettroni nei gusci esterni subiscono la stessa entità di questo effetto; ad esempio, se occupi un orbitale che ha un carattere altamente penetrante (cioè che transita molto vicino al nucleo e ad altri orbitali), allora sentirai una Zef più alta.
Di conseguenza, nasce un ordine di stabilità energetica in funzione di questi Zef per gli orbitali: s Ciò significa che l'orbitale 2p ha un'energia maggiore (meno stabilizzata dalla carica del nucleo) rispetto all'orbitale 2s.. Quanto più povero è l'effetto di penetrazione esercitato dall'orbitale, tanto minore sarà il suo effetto schermante sul resto degli elettroni esterni. Gli orbitali d e f mostrano molti buchi (nodi) in cui il nucleo attrae altri elettroni. Supponendo che le cariche negative siano localizzate, la formula per calcolare Zef per qualsiasi elettrone è: Zef = Z - σ In questa formula σ è la costante di schermatura determinata dagli elettroni del kernel. Questo perché, in teoria, gli elettroni più esterni non contribuiscono alla schermatura degli elettroni interni. In altre parole, 1sDue scudo elettrone 2s1, ma 2s1 non protegge gli elettroni Z 1sDue. Se Z = 40, trascurando gli effetti menzionati, l'ultimo elettrone sperimenterà uno Zef uguale a 1 (40-39). La regola di Slater è una buona approssimazione dei valori Zef per gli elettroni nell'atomo. Per applicarlo, segui i passaggi seguenti: 1- La configurazione elettronica dell'atomo (o ione) dovrebbe essere scritta come segue: (1s) (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f) ... 2- Gli elettroni che si trovano a destra di quello considerato non contribuiscono all'effetto schermante. 3- Gli elettroni che si trovano all'interno dello stesso gruppo (contrassegnati dalle parentesi) forniscono 0,35 la carica dell'elettrone a meno che non sia il gruppo 1s, essendo invece 0,30. 4- Se l'elettrone occupa un orbitale so p, tutti gli orbitali n-1 contribuiscono con 0,85 e tutti gli orbitali n-2 un'unità. 5- Nel caso in cui l'elettrone occupi un orbitale do f, tutti quelli alla sua sinistra contribuiscono di un'unità. Seguendo la modalità di rappresentazione di Slater, la configurazione elettronica di Be (Z = 4) è: (1sDue) (2sDue2 P0) Poiché ci sono due elettroni nell'orbitale, uno di questi contribuisce alla schermatura dell'altro e l'orbitale 1s è l'n-1 dell'orbitale 2s. Quindi, sviluppando la somma algebrica, abbiamo quanto segue: (0,35) (1) + (0,85) (2) = 2,05 Lo 0,35 proveniva dall'elettrone 2s e lo 0,85 dai due elettroni 1s. Ora, applicando la formula di Zef: Zef = 4 - 2,05 = 1,95 Cosa significa questo? Significa che gli elettroni nell'orbitale 2sDue sperimenta una carica di +1,95 che li attira verso il nucleo, invece dell'effettiva carica di +4. Ancora una volta, continua come nell'esempio precedente: (1sDue) (2sDue2 P6) (3sDue3p3) Ora la somma algebrica viene sviluppata per determinare σ: (, 35) (4) + (0,85) (8) + (1) (2) = 10,2 Quindi, Zef è la differenza tra σ e Z: Zef = 15-10,2 = 4,8 In conclusione, gli ultimi elettroni 3p3 subiscono un carico tre volte inferiore a quello reale. Va anche notato che, secondo questa regola, gli elettroni 3sDue sperimentare lo stesso Zef, un risultato che potrebbe far sorgere dubbi al riguardo. Tuttavia, ci sono modifiche alla regola di Slater che aiutano ad approssimare i valori calcolati di quelli effettivi..Come calcolarlo?
La regola di Slater
Esempi
Determina Zef per gli elettroni nell'orbitale 2sDue in berillio
Determina Zef per gli elettroni nell'orbitale 3p3 di fosforo
Riferimenti



Nessun utente ha ancora commentato questo articolo.