
Proprietà, struttura, ottenimento, usi del carbonio
Il carbonio È un elemento chimico non metallico il cui simbolo chimico è C. Deve il suo nome al carbone, vegetale o minerale, dove i suoi atomi definiscono varie strutture. Molti autori lo qualificano come il Re degli elementi, poiché forma un'ampia gamma di composti organici e inorganici e si trova anche in un numero considerevole di allotropi..
E se questo non è sufficiente per riferirsi ad esso come a un elemento speciale, si trova in tutti gli esseri viventi; tutte le sue biomolecole devono la loro esistenza alla stabilità e forza dei legami C-C e alla loro elevata tendenza a concatenarsi. Il carbonio è l'elemento della vita e con i suoi atomi vengono costruiti i loro corpi.

I composti organici con cui sono costruiti i biomateriali sono praticamente costituiti da scheletri di carbonio ed eteroatomi. Questi possono essere visti ad occhio nudo nel bosco degli alberi; e anche quando la folgore li colpisce e li arrostisce. Il restante solido nero inerte ha anche carbonio; ma si tratta di carbone.
Quindi, ci sono manifestazioni "morte" di questo elemento: carbone di legna, un prodotto della combustione in ambienti poveri di ossigeno; e carbone minerale, un prodotto di processi geologici. Entrambi i solidi si assomigliano, sono neri e bruciano per generare calore ed energia; anche se con rese diverse.
Da questo punto in poi, il carbonio è il quindicesimo elemento più abbondante nella crosta terrestre. Non c'è da stupirsi quando ogni anno vengono prodotti milioni di tonnellate di carbone. Questi minerali differiscono nelle loro proprietà a seconda del grado di impurità, ponendo l'antracite come carbone minerale di altissima qualità..
La crosta terrestre non è solo ricca di carbone minerale, ma anche di carbonati, soprattutto calcarei e dolomiti. E per quanto riguarda l'Universo, è il quarto elemento più abbondante; Voglio dire, c'è più carbonio là fuori su altri pianeti.
Indice articolo
- 1 Storia del carbonio
- 1.1 Guardando indietro
- 1.2 Riconoscimento
- 2 Proprietà
- 2.1 Grafite vs diamante
- 3 Struttura e configurazione elettronica
- 3.1 Ibridazioni
- 3.2 numeri di ossidazione
- 3.3 Geometrie molecolari
- 3.4 Solidi amorfi o cristallini
- 4 Ottenimento
- 5 Usi
- 6 Rischi e precauzioni
- 7 Riferimenti
Storia del carbonio
Retrospettiva
Il carbonio può essere vecchio quanto la crosta terrestre stessa. Da tempo immemorabile, antiche civiltà hanno incontrato questo elemento nelle sue numerose presentazioni naturali: fuliggine, carbone di legna, carbone di legna, carbone di legna, diamanti, grafite, catrame di carbone, antracite, ecc..
Tutti quei solidi, sebbene condividessero i toni scuri (ad eccezione del diamante), il resto delle loro proprietà fisiche, così come la loro composizione, differivano notevolmente. Allora era impossibile affermare che consistessero essenzialmente di atomi di carbonio.
È stato così che nel corso della storia, il carbone è stato classificato in base alla sua qualità durante la combustione e la fornitura di calore. E con i gas formati dalla sua combustione si riscaldavano masse d'acqua, che a loro volta producevano vapori che muovevano turbine che generavano correnti elettriche..
Il carbonio era inaspettatamente presente nel carbone prodotto dalla combustione di alberi in spazi chiusi o ermetici; nella grafite con cui sono state realizzate le matite; in diamanti usati come gemme; era responsabile della durezza dell'acciaio.
La sua storia va di pari passo con il legno, la polvere da sparo, i gas per l'illuminazione delle città, i treni e le navi, la birra, i lubrificanti e altri oggetti essenziali per il progresso dell'umanità..
Riconoscimento
A che punto gli scienziati sono stati in grado di associare gli allotropi e i minerali del carbonio allo stesso elemento? Il carbone era visto come un minerale e non era pensato come un elemento chimico degno della tavola periodica. Il primo passo avrebbe dovuto essere quello di mostrare che tutti questi solidi sono stati trasformati nello stesso gas: anidride carbonica, CODue.
Antoine Lavoisier nel 1772, utilizzando una montatura in legno con grandi lenti, focalizzò i raggi del sole su campioni di carbone e un diamante. Ha scoperto che nessuno dei due formava vapori d'acqua ma CODue. Ha fatto lo stesso con la fuliggine e ha ottenuto gli stessi risultati..
Carl Wilhelm Scheele nel 1779, trovò la relazione chimica tra carbone e grafite; cioè, entrambi i solidi erano composti dagli stessi atomi.
Smithson Tennant e William Hyde Wollaston nel 1797 verificarono metodologicamente (attraverso reazioni) che il diamante era effettivamente composto da carbonio producendo CODue nella sua combustione.
Con questi risultati, la luce fu presto lanciata su grafite e diamante, solidi formati dal carbonio e quindi di elevata purezza; a differenza dei solidi impuri del carbone e di altri minerali carboniosi.
Proprietà
Le proprietà fisiche o chimiche che si trovano in solidi, minerali o materiali carboniosi sono soggette a molte variabili. Tra questi ci sono: la composizione o il grado di impurità, le ibridazioni degli atomi di carbonio, la diversità delle strutture e la morfologia o dimensione dei pori..
Quando vengono descritte le proprietà del carbonio, la maggior parte dei testi o delle fonti bibliografiche si basano su grafite e diamante..
Perché? Perché sono gli allotropi più noti per questo elemento e rappresentano solidi o materiali di elevata purezza; ovvero, sono praticamente costituiti da nient'altro che atomi di carbonio (sebbene con strutture differenti, come verrà spiegato nella prossima sezione).
Le proprietà del carbone di legna e del carbone minerale differiscono rispettivamente per origine o composizione. Ad esempio, la lignite (a basso tenore di carbonio) come carburante striscia rispetto all'antracite (ad alto tenore di carbonio). E che dire degli altri allotropi: nanotubi, fullereni, grafeni, graffin, ecc..
Tuttavia, chimicamente hanno un punto in comune: si ossidano con un eccesso di ossigeno in CODue:
C + ODue => CODue
Ora, la velocità o la temperatura che richiedono per ossidarsi sono specifiche per ciascuno di questi allotropi..
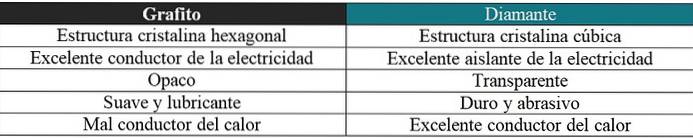
Grafite vs diamante
Verrà anche fatto un breve commento in merito alle proprietà molto diverse per questi due allotropi:
Struttura e configurazione elettronica
Ibridazioni
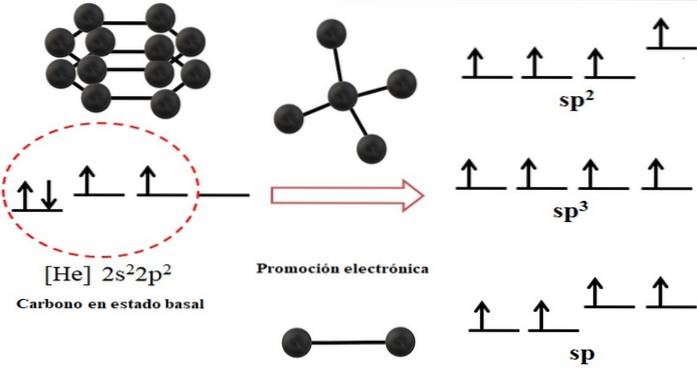
La configurazione elettronica per l'atomo di carbonio è 1sDue2sDue2 PDue, scritto anche come [He] 2sDue2 PDue (immagine in alto). Questa rappresentazione corrisponde al suo stato fondamentale: l'atomo di carbonio isolato e sospeso in un vuoto tale da non poter interagire con gli altri..
Si può vedere che uno dei suoi orbitali 2p è privo di elettroni, che accetta un elettrone dall'orbitale di energia inferiore 2s attraverso la promozione elettronica; e così, l'atomo acquisisce la capacità di formare fino a quattro legami covalenti attraverso i suoi quattro orbitali ibridi sp3.
Notare che i quattro orbitali sp3 sono degenerati in energia (allineati sullo stesso livello). Orbitali p puri sono più energici, motivo per cui sono sopra gli altri orbitali ibridi (a destra dell'immagine).
Se ci sono tre orbitali ibridi, è perché rimane un orbitale p senza ibridare; quindi, sono tre orbitali spDue. E quando ci sono due di questi orbitali ibridi, due orbitali p sono disponibili per formare doppi o tripli legami, essendo l'ibridazione del carbonio sp.
Tali aspetti elettronici sono essenziali per capire perché il carbonio può essere trovato in infiniti allotropi..
Numeri di ossidazione
Prima di continuare con le strutture, vale la pena ricordare che, data la configurazione elettronica di valenza 2sDue2 PDue, il carbonio può avere i seguenti numeri di ossidazione: +4, +2, 0, -2 e -4.
Perché? Questi numeri corrispondono al presupposto che esista un legame ionico tale da formare gli ioni con le rispettive cariche; cioè, C4+, CDue+, C0 (neutro), CDue- e C4-.
Perché il carbonio abbia un numero di ossidazione positivo, deve perdere elettroni; e per farlo, deve necessariamente essere legato ad atomi molto elettronegativi (come l'ossigeno).
Nel frattempo, affinché il carbonio abbia un numero di ossidazione negativo, deve guadagnare elettroni legandosi ad atomi metallici o meno elettronegativo di esso (come l'idrogeno).
Il primo numero di ossidazione, +4, significa che il carbonio ha perso tutti gli elettroni di valenza; gli orbitali 2s e 2p rimangono vuoti. Se l'orbitale 2p perde i suoi due elettroni, il carbonio avrà un numero di ossidazione di +2; se guadagni due elettroni, avrai -2; e se guadagni altri due elettroni completando il tuo ottetto di valenza, -4.
Esempi
Ad esempio, per CODue il numero di ossidazione del carbonio è +4 (perché l'ossigeno è più elettronegativo); mentre per il CH4, è -4 (perché l'idrogeno è meno elettronegativo).
Per il CH3OH, il numero di ossidazione del carbonio è -2 (+1 per H e -2 per O); mentre per HCOOH è +2 (controlla che la somma dia 0).
Sono probabili anche altri stati di ossidazione, come -3 e +3, soprattutto quando si tratta di molecole organiche; ad esempio, nei gruppi metilici, -CH3.
Geometrie molecolari
L'immagine in alto non solo mostrava l'ibridazione degli orbitali per l'atomo di carbonio, ma anche le geometrie molecolari risultanti quando diversi atomi (sfere nere) erano collegati a uno centrale. Questo atomo centrale per avere uno specifico ambiente geometrico nello spazio, deve avere la rispettiva ibridazione chimica che lo consente..
Ad esempio, per il tetraedro il carbonio centrale ha ibridazione sp3; perché tale è la disposizione più stabile per i quattro orbitali ibridi sp3. Nel caso degli atomi di carbonio spDue, possono formare doppi legami e avere un ambiente sul piano trigonale; e così questi triangoli definiscono un esagono perfetto. E per un'ibridazione sp, i carboni adottano una geometria lineare.
Pertanto, le geometrie osservate nelle strutture di tutti gli allotropi sono semplicemente governate nei tetraedri (sp3), esagoni o pentagoni (spDue) e linee (sp).
I tetraedri definiscono una struttura 3D, mentre esagoni, pentagoni e linee, strutture 3D o 2D; Questi ultimi vengono per essere i piani o fogli simili alle pareti dei favi:

E se pieghiamo questa parete esagonale (pentagonale o mista), otterremo un tubo (nanotubi) o una palla (fullereni) o un'altra figura. Le interazioni tra queste figure danno luogo a diverse morfologie.
Solidi amorfi o cristallini
Tralasciando le geometrie, le ibridazioni o le morfologie delle possibili strutture del carbonio, i suoi solidi possono essere classificati globalmente in due tipi: amorfi o cristallini. E tra queste due classificazioni sono distribuiti i loro allotropi.
Il carbonio amorfo è semplicemente quello che presenta una miscela arbitraria di tetraedri, esagoni o linee, incapace di stabilire un modello strutturale; è il caso del carbone, del carbone di legna o del carbone attivo, del coke, della fuliggine, ecc..
Mentre il carbonio cristallino è costituito da modelli strutturali formati da una qualsiasi delle geometrie proposte; ad esempio, diamante (rete tridimensionale di tetraedri) e grafite (fogli esagonali impilati).
Ottenere
Il carbonio può essere puro come la grafite o il diamante. Questi si trovano nei rispettivi depositi mineralogici, sparsi in tutto il mondo e in diversi paesi. Ecco perché alcune nazioni sono più esportatrici di uno di questi minerali rispetto ad altre. In breve, "devi scavare la terra" per ottenere il carbonio.
Lo stesso vale per il carbone minerale e i suoi tipi. Ma questo non è il caso del carbone, poiché un corpo ricco di carbonio deve prima "perire", o sotto il fuoco, o sotto un fulmine elettrico; ovviamente, in assenza di ossigeno, altrimenti verrebbe rilasciato CODue.
Un'intera foresta è una fonte di carbonio come il carbone; non solo per i suoi alberi, ma anche per la sua fauna.
In generale, i campioni contenenti carbonio devono essere sottoposti a pirolisi (combustione in assenza di ossigeno) per rilasciare alcune delle impurità sotto forma di gas; e così, un solido ricco di carbonio (amorfo o cristallino) rimane come residuo.
Applicazioni
Ancora una volta, come le proprietà e la struttura, gli usi o le applicazioni sono coerenti con gli allotropi o le forme mineralogiche del carbonio. Tuttavia, ci sono alcune generalità che possono essere menzionate, oltre ad alcuni punti ben noti. Tali sono:
-Il carbonio è stato a lungo utilizzato come agente riducente minerale per ottenere metalli puri; ad esempio ferro, silicio e fosforo, tra gli altri.
-È la pietra angolare della vita e la chimica organica e la biochimica sono gli studi di questa riflessione..
-È stato anche un combustibile fossile che ha permesso alle prime macchine di girare le loro marce. Allo stesso modo da esso si ricavava il gas di carbonio per i vecchi sistemi di illuminazione. Il carbone era sinonimo di luce, calore ed energia.
-Miscelato come additivo con ferro in proporzioni diverse, ha permesso l'invenzione e il perfezionamento degli acciai.
-Il suo colore nero ha avuto luogo nell'arte, in particolare la grafite e tutte le scritte fatte con i suoi tratti..
Rischi e precauzioni
Il carbonio ei suoi solidi non rappresentano alcun rischio per la salute. A chi è mai importato un sacchetto di carbone? Sono venduti a frotte all'interno dei corridoi di alcuni mercati e finché non c'è fuoco nelle vicinanze, i loro blocchi neri non bruceranno..
La coca cola, d'altra parte, può rappresentare un rischio se il suo contenuto di zolfo è elevato. Quando viene bruciato, rilascia gas di zolfo che, oltre ad essere tossici, contribuiscono alle piogge acide. E sebbene il CODue in piccole quantità non può soffocarci, esercita un enorme impatto sull'ambiente come gas serra.
Da questo punto di vista, il carbonio è un pericolo "a lungo termine", poiché la sua combustione altera il clima del nostro pianeta..
E in un senso più fisico, i materiali solidi o carboniosi se vengono polverizzati sono facilmente trasportati dalle correnti d'aria; e di conseguenza vengono introdotti direttamente nei polmoni, che possono danneggiarli irreparabilmente.
Per il resto, è molto comune consumare "carbone di legna" quando alcuni cibi sono cotti.
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Andrea. (2019). Carbonio, suoi allotropi e strutture. Estratto da: everyscience.com
- Advameg, Inc. (2019). Carbone. Chimica spiegata. Estratto da: chemistryexplained.com
- Helmenstine, Anne Marie, Ph.D. (11 luglio 2018). 10 dati sul carbonio (numero atomico 6 o C). Estratto da: thoughtco.com
- Tawnya Eash. (2019). Cos'è il carbonio? - Fatti e lezione di storia per bambini. Studia. Estratto da: study.com
- Föll. (s.f.). Storia del carbonio. Estratto da: tf.uni-kiel.de



Nessun utente ha ancora commentato questo articolo.