
Struttura, proprietà, usi del carbonato di litio (Li2CO3)

Il carbonato di litio è un solido inorganico formato da due cationi di litio+ e un anione carbonato CO3Due-. La sua formula chimica è LiDueCO3. Il LiDueCO3 è un solido cristallino bianco che può essere ottenuto dalla reazione tra idrossido di litio e anidride carbonica.
Il carbonato di litio ha un punto di fusione molto alto, motivo per cui viene utilizzato nella preparazione di bicchieri, ceramiche e porcellane. Ha un'ampia varietà di usi, come nelle batterie al litio ricaricabili, nella preparazione di altri composti di litio, negli elettrodi per saldatura e nelle pitture e vernici..

Viene utilizzato anche LiDueCO3 in impasti cementizi per presa rapida e produzione di alluminio.
Uno dei suoi usi più importanti è nel trattamento di alcune malattie mentali come la depressione e comportamenti eccessivamente aggressivi, tra le altre condizioni..
Tuttavia, il suo uso come medicinale deve essere debitamente controllato da medici specialisti poiché le persone trattate con LiDueCO3 può subire effetti dannosi sulla salute, come l'ipotiroidismo (ridotta funzionalità della ghiandola tiroidea).
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà fisiche
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Decomposizione
- 3.5 Densità
- 3.6 Solubilità
- 3,7 pH
- 4 Proprietà chimiche
- 5 Proprietà biologiche
- 6 Ottenimento
- 7 Usi
- 7.1 Nel trattamento delle malattie mentali
- 7.2 Nel trattamento dei sintomi di altre malattie
- 7.3 Metodo di somministrazione
- 8 Effetti avversi
- 8.1 Casi in cui non deve essere somministrato
- 9 Altri usi
- 10 riferimenti
Struttura
Il carbonato di litio è costituito da due cationi di litio+ e un anione carbonato CO3Due-.
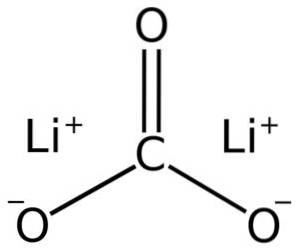
La configurazione elettronica del litio nello stato di ossidazione +1 è 1sDue 2s0, poiché ha perso l'elettrone dell'ultimo guscio, risultando così più stabile. Lo ione carbonato CO3Due- ha una struttura piatta.
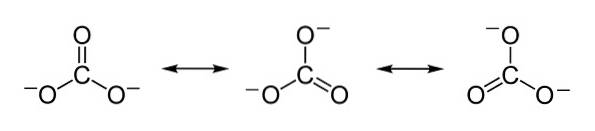
Le cariche negative sono equamente distribuite tra i tre atomi di ossigeno dello ione carbonato CO3Due-.
Nomenclatura
-Carbonato di litio
-Carbonato di dilitio
Proprietà fisiche
Stato fisico
Solido cristallino bianco con struttura monoclina
Peso molecolare
73,9 g / mol
Punto di fusione
723 ºC
Decomposizione
Si decompone a 1300 ºC.
Densità
2,11 g / cm3
Solubilità
Leggermente solubile in acqua: 1,31% in peso a 20 ºC. La sua solubilità in acqua diminuisce con l'aumentare della temperatura. È solubile in acidi diluiti. È insolubile in alcool e acetone.
pH
Le soluzioni in acqua sono alcaline, hanno un pH maggiore di 7.
Proprietà chimiche
Il LiDueCO3 idrolizza in soluzione acquosa generando una soluzione basica. La piccola proporzione del composto che viene solubilizzato in acqua lascia l'anione carbonato CO libero.3Due-.
L'anione carbonato CO3Due- libero in soluzione acquosa impiega un protone per formare l'anione bicarbonato HCO3-, come si può vedere nella seguente reazione:
CO3Due- + HDueO → HCO3- + Oh-
La presenza di ioni OH- è ciò che rende la soluzione di base.
Proprietà biologiche
Tracce di ioni di litio sono normalmente presenti nei tessuti animali e umani, ma finora non è noto alcun ruolo fisiologico naturale di questo ione..
Nell'organismo umano il LiDueCO3 ingerito come farmaco, agisce su una varietà di meccanismi di segnalazione nei neuroni e in altre cellule. Ciò risulta dalla sostituzione di cationi come sodio e potassio.
L'incorporazione di ioni di litio nella struttura della membrana cellulare può alterare la risposta agli ormoni e l'accoppiamento della cellula con i processi energetici.
In questo modo, il litio modifica diversi processi cellulari compreso il metabolismo..
Modificando il modo in cui funzionano le cellule, LiDueCO3 può agire sui meccanismi di comunicazione dei neuroni nel cervello.
Ottenere
Il LiDueCO3 può essere ottenuto dalla reazione di idrossido di litio LiOH con anidride carbonica CODue, come mostrato di seguito:
2 LiOH + CODue → LiDueCO3 + HDueO
È prodotto commercialmente da minerali contenenti litio come spodumene e lepidolite. Questi minerali vengono trattati ad alte temperature con alcuni sali solfati o con composti alcalini per ottenere sali di litio..
I sali di litio ottenuti vengono purificati con acqua o soluzioni acide e quindi trattati con carbonati per formare LiDueCO3.
Tuttavia, il LiDueCO3 Ottenuto in questo modo, viene contaminato da solfati o cloruri di calcio, magnesio, ferro, sodio, potassio, ecc. quindi richiede un'ulteriore purificazione.
Applicazioni
Nel trattamento della malattia mentale
È usato come antidepressivo, agente antimanico, nel trattamento di comportamenti aggressivi-impulsivi e per i disturbi bipolari (persone che cambiano improvvisamente il loro umore senza alcuna causa, diventando violente).

I medici hanno osservato che la sua somministrazione porta a una diminuzione dell'intensità e della frequenza di periodi gravi di depressione ed episodi maniacali..
Viene utilizzato da solo, cioè senza alcun composto aggiunto, nella terapia di mantenimento della depressione unipolare e del disturbo schizoaffettivo. Serve anche ad aumentare l'effetto antidepressivo di altri farmaci.
Sebbene sia stato usato per trattare bambini con sintomi apparenti di disturbo bipolare e iperattività con componenti nevrotiche o aggressive, non è stato efficace in tutti i casi..
Nel trattamento dei sintomi di altre malattie
Viene utilizzato per ridurre la frequenza delle cefalee gravi, ricorrenti e croniche.
Viene utilizzato per ridurre l'incidenza di infezioni nei pazienti con neutropenia indotta dalla chemioterapia o per altri motivi. La neutropenia è una diminuzione dei neutrofili, un tipo di globuli bianchi che aiuta a combattere le infezioni nel corpo.
È stato usato come inibitore degli enzimi tiroidei per il trattamento dell'ipertiroidismo, ma non è il trattamento preferito a causa dei suoi effetti avversi.
Forma di amministrazione
È usato sotto forma di compresse o capsule di LiDueCO3. Anche in compresse a lento rilascio con citrato di litio. Li è preferitoDueCO3 perché non irrita la gola se ingerito, come nel caso di altri sali di litio.

Effetti collaterali
Il LiDueCO3 può avere un effetto dannoso sulla tiroide e sui reni, quindi la funzione di questi organi deve essere monitorata prima e durante il trattamento con questo composto..
Il LiDueCO3 può essere tossico a concentrazioni molto vicine a quelle utilizzate nei trattamenti medici, quindi è necessaria una continua revisione dei suoi valori nel siero del sangue.
Sintomi dell'avvelenamento da LiDueCO3 sono tremori, spasmi muscolari, debolezza muscolare, diarrea, vomito, sonnolenza o atassia (ridotta coordinazione muscolare), tra gli altri.
Quando si inizia la terapia con LiDueCO3 Possono verificarsi anche sintomi come tremori, mal di testa e nausea. Ma questi tendono a scomparire man mano che il farmaco continua..
La maggior parte delle persone trattate può anche sviluppare leucocitosi (un aumento del numero di globuli bianchi), ma questo è reversibile..
Persone che vengono curate con LiDueCO3 non devono guidare veicoli o utilizzare macchinari, poiché la coordinazione fisica e la capacità di svolgere attività che richiedono attenzione diminuiscono.
Casi in cui non deve essere somministrato
Non deve essere utilizzato nei bambini di età inferiore ai 12 anni, poiché può interferire con la formazione delle ossa e la loro densità, poiché altera le concentrazioni di un ormone tiroideo. Tende anche a sostituire il calcio nelle ossa..
Non dovrebbero essere trattati con LiDueCO3 persone con malattie cardiovascolari, renali o tiroidee. Né in pazienti gravemente disidratati.
Non deve essere somministrato a donne in gravidanza soprattutto durante il primo trimestre di gravidanza. Il litio attraversa la placenta e può raggiungere facilmente il feto con possibili effetti teratogeni, cioè può causare anomalie o malformazioni nel feto..
Persone anziane che richiedono un trattamento con LiDueCO3 vanno trattati con molta cura e con dosi inferiori a quelle dei giovani adulti, in quanto possono sviluppare malattie ipotiroidee.
Altri usi
Il LiDueCO3 l'elevata purezza è ampiamente utilizzata nella produzione di batterie al litio ricaricabili.
Utilizzato nelle celle a combustibile a carbonato fuso.
Viene utilizzato nella produzione di porcellana elettrica, che è un tipo di porcellana elettricamente isolante. Viene utilizzato anche nella produzione di smalti su ceramica.

Permette la preparazione di ceramiche con un basso coefficiente di espansione, cioè si espande pochissimo con l'aumentare della temperatura, quindi la ceramica può essere utilizzata in un intervallo di temperatura più elevato.
Altri usi sono come catalizzatore, nella produzione di altri composti di litio, come rivestimento per elettrodi di saldatura, in formule di vernici luminescenti, vernici e coloranti, nonché nella produzione elettrolitica di alluminio..
È utile per generare una presa più rapida del cemento e viene aggiunto alla colla delle piastrelle in modo che possano essere fissate in breve tempo.

Riferimenti
- Cai, W. et al. (2018). Rimozione di SO4Due- di LiDueCO3 per ricristallizzazione in NaDueCO3. Cristalli 2018, 8, 19. Recupero da mdpi.com.
- Gadikota, G. (2017). Collegamento dei cambiamenti morfologici e strutturali cristallini durante la conversione dell'idrossido di litio monoidrato in carbonato di litio utilizzando misurazioni di dispersione dei raggi X su più scale. Minerali 2017, 7, 169. Recupero da mdpi.com.
- NOI. Biblioteca nazionale di medicina. (2019). Carbonato di litio. Estratto da: pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Quarta edizione. John Wiley & Sons.
- Enciclopedia della chimica industriale di Ullmann. (1990). Quinta edizione. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.

Nessun utente ha ancora commentato questo articolo.