
Formule assorbite dal calore, come calcolarlo ed esercizi risolti
Il calore assorbito È definito come il trasferimento di energia tra due corpi a temperature diverse. Quello con una temperatura più bassa assorbe il calore di quello con una temperatura più alta. Quando ciò accade, l'energia termica della sostanza che assorbe il calore aumenta e le particelle che la compongono vibrano più velocemente, elevando la loro energia cinetica..
Ciò può comportare un aumento della temperatura o un cambiamento di stato. Ad esempio, passa da solido a liquido, come il ghiaccio quando si scioglie a contatto con acqua o soda a temperatura ambiente.

Grazie al calore è anche possibile che gli oggetti cambino le loro dimensioni. L'espansione termica è un buon esempio di questo fenomeno. Quando la maggior parte delle sostanze viene riscaldata, di solito subiscono un aumento delle loro dimensioni.
Un'eccezione a questo è l'acqua. La stessa quantità di acqua liquida aumenta il suo volume quando si raffredda sotto i 4 ºC. Inoltre, i cambiamenti di temperatura possono anche subire cambiamenti nella sua densità, qualcosa anche molto osservabile nel caso dell'acqua..
Indice articolo
- 1 In cosa consiste e formule
- 1.1 Calorie
- 2 Come calcolarlo?
- 2.1 Il bilancio energetico
- 3 Esercizio risolto
- 3.1 Approccio
- 3.2 Dati
- 4 Riferimenti
In cosa consiste e formule
Nel caso di energia in transito, le unità di calore assorbito sono Joule. Tuttavia, per molto tempo il calore ha avuto le sue unità: le calorie.
Ancora oggi questa unità viene utilizzata per quantificare il contenuto energetico degli alimenti, anche se in realtà una caloria alimentare corrisponde ad una kilocaloria di calore.
Calorie
La caloria, abbreviata in lime, è la quantità di calore necessaria per aumentare la temperatura di 1 grammo di acqua di 1 º C.
Nel XIX secolo Sir James Prescott Joule (1818 - 1889) realizzò un famoso esperimento in cui riuscì a trasformare il lavoro meccanico in calore, ottenendo la seguente equivalenza:
1 caloria = 4,186 Joule
Nelle unità britanniche, l'unità di calore è chiamata Btu (Unità termica britannica), che è definita come la quantità di calore necessaria per aumentare la temperatura di una libbra di acqua di 1ºF.
L'equivalenza tra le unità è la seguente:
1 Btu = 252 calorie
Il problema con queste unità più vecchie è che la quantità di calore dipende dalla temperatura. Cioè, quello richiesto per passare da 70ºC a 75ºC non è lo stesso di quello richiesto per riscaldare l'acqua da 9ºC a 10ºC, per esempio..
Ecco perché la definizione contempla intervalli ben definiti: da 14,5 a 15,5 ° C e da 63 a 64 ° F rispettivamente per le calorie e Btu..
Da cosa dipende la quantità di calore assorbito?
La quantità di calore assorbito che un materiale raccoglie dipende da diversi fattori:
- Massa. Più grande è la massa, più calore è in grado di assorbire.
- Caratteristiche della sostanza. Esistono sostanze che, a seconda della loro struttura molecolare o atomica, sono in grado di assorbire più calore di altre..
- Temperatura. L'aggiunta di più calore è necessaria per ottenere una temperatura più alta.
La quantità di calore, indicata come Q, è proporzionale ai fattori descritti. Pertanto, può essere scritto come:
Q = m.c. ΔT
Dove m è la massa dell'oggetto, c è una chiamata costante calore specifico, una proprietà intrinseca della sostanza e ΔT è la variazione di temperatura ottenuta assorbendo il calore.
ΔT = TF - To
Questa differenza ha un segno positivo, poiché quando si assorbe calore ci si aspetta che TF > To. Ciò si verifica a meno che la sostanza non stia subendo un cambiamento di fase, come l'acqua che passa da liquido a vapore. Quando l'acqua bolle, la sua temperatura rimane costante a circa 100 ° C, indipendentemente dalla velocità con cui bolle..
Come calcolarlo?
Mettendo in contatto due oggetti a temperature diverse, dopo un po 'raggiungono l'equilibrio termico. Quindi le temperature si equalizzano e il trasferimento di calore cessa. Lo stesso accade se più di due oggetti entrano in contatto. Dopo un certo tempo saranno tutti alla stessa temperatura.
Supponendo che gli oggetti a contatto formino un sistema chiuso, dal quale il calore non può fuoriuscire, si applica il principio di conservazione dell'energia, per cui si può affermare che:
Q assorbito = - Q ceduto
Questo rappresenta un bilancio energetico, simile a quello delle entrate e delle spese di una persona. Per questo motivo il calore ceduto ha segno negativo, poiché per l'oggetto che cede, la temperatura finale è inferiore a quella iniziale. Perciò:
ΔT = TF - To < 0
L'equazione Q assorbito = - Q ceduto viene utilizzato ogni volta che due oggetti sono in contatto.
Bilancio energetico
Per effettuare il bilancio energetico è necessario distinguere gli oggetti che assorbono calore da quelli che lo cedono, quindi:
Σ QK= 0
Cioè, la somma dei guadagni e delle perdite di energia in un sistema chiuso deve essere uguale a 0.
Il calore specifico di una sostanza
Per calcolare la quantità di calore assorbita è necessario conoscere il calore specifico di ciascuna sostanza partecipante. Questa è la quantità di calore necessaria per aumentare la temperatura di 1 g di materiale di 1 ° C. Le sue unità nel Sistema Internazionale sono: Joule / kg. K.
Esistono tabelle con il calore specifico di molte sostanze, generalmente calcolato utilizzando un calorimetro o strumenti simili..
Un esempio di come calcolare il calore specifico di un materiale
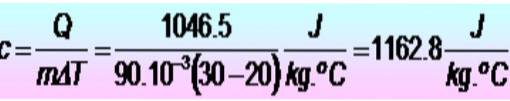
Sono necessarie 250 calorie per aumentare la temperatura di un anello di metallo da 20 a 30 ºC. Se l'anello ha una massa di 90 g. Qual è il calore specifico del metallo nelle unità SI??
Soluzione
Le unità vengono convertite per prime:
Q = 250 calorie = 1046,5 J
m = 90 g = 90 x 10-3 kg
Esercizio risolto
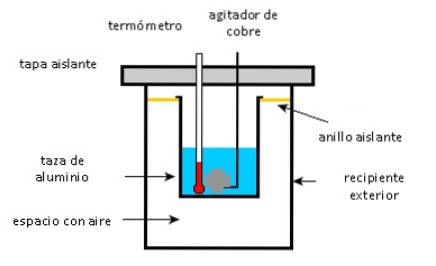
Una tazza di alluminio contiene 225 g di acqua e un agitatore di rame da 40 g, il tutto a 27 ° C. Un campione di 400 g di argento ad una temperatura iniziale di 87 ° C viene posto nell'acqua.
L'agitatore serve per mescolare la miscela fino a raggiungere la temperatura di equilibrio finale di 32 ° C. Calcola la massa della tazza in alluminio, considerando che non ci sono dispersioni di calore nell'ambiente.
Approccio
Come detto sopra, è importante distinguere tra oggetti che cedono calore da quelli che assorbono:
- Tazza di alluminio, agitatore di rame e acqua assorbono il calore.
- Il campione d'argento produce calore.
Dati
Vengono forniti i calori specifici di ciascuna sostanza:
- Argento: c = 234 J / kg. ºC
- Rame: c = 387 J / kg. ºC
- Alluminio c = 900 J / kg. ºC
- Acqua c = 4186 J / kg. ºC
Il calore assorbito o trasferito da ciascuna sostanza viene calcolato utilizzando l'equazione:
Q = m.c.λT
Soluzione
Argento
Q ceduto = 400 x 10 -3 . 234 x (32-87) J = -5148 J
Agitatore in rame
Q assorbito = 40 x 10 -3 . 387 x (32-27) J = 77,4 J
acqua
Q assorbito = 225 x 10 -3 . 4186 x (32-27) J = 4709,25 J
Tazza in alluminio
Q assorbito = m alluminio . 900 x (32-27) J = 4500 m alluminio
Facendo uso di:
Σ QK= 0
77,4 + 4709,25 + 4500 m alluminio = - (-5148)
Alla fine la massa dell'alluminio viene cancellata:
m alluminio = 0,0803 kg = 80,3 g
Riferimenti
- Giancoli, D. 2006. Fisica: principi con applicazioni. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fisica: uno sguardo al mondo. 6ta Edizione abbreviata. Cengage Learning. 156 - 164.
- Rex, A. 2011. Fondamenti di fisica. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Fisica universitaria con fisica moderna. 14th. Volume 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fondamenti di fisica. 9n / A Cengage Learning. 362 - 374



Nessun utente ha ancora commentato questo articolo.