
Struttura, proprietà e usi del bromuro di sodio (NaBr)
Il bromuro di sodio è una specie chimica che appartiene ai sali di origine inorganica. La sua struttura è composta dall'alogeno bromo e dall'elemento metallico sodio in rapporto 1: 1. La sua formula chimica è NaBr ed è allo stato solido di aggregazione in condizioni di temperatura e pressione standard (25 ° C e 1 atm).
Normalmente può essere visto come una polvere bianca, ed è considerato un composto di tipo cristallino che presenta anche un comportamento igroscopico; cioè, ha la capacità di assorbire l'umidità dall'ambiente circostante.

Allo stesso modo, il bromuro di sodio ha caratteristiche fisiche molto simili a un altro composto ionico dello stesso metallo: il cloruro di sodio. Questo cloruro è rappresentato come NaCl, che è più comunemente noto come sale comune o sale da cucina..
Ha un gran numero di usi in diversi campi della scienza; Ad esempio, viene utilizzato nella produzione di vari tipi di farmaci (sedativi, ipnotici, anticonvulsivanti, tra gli altri), nonché nelle sintesi organiche e persino nelle applicazioni fotografiche..
Indice articolo
- 1 Struttura chimica
- 1.1 Sintesi chimica
- 2 Proprietà
- 3 usi
- 4 Riferimenti
Struttura chimica
Come accennato in precedenza, il bromuro di sodio si presenta nella fase solida e, come molti altri sali di natura inorganica, ha una conformazione strutturale cristallina..
Questa molecola cristallina, composta da un bromo e un atomo di idrogeno, ha una conformazione di tipo cubico a facce centrate, come i sali di tipo alogenuro dello stesso metallo (NaI, NaF e NaCl).
Questa disposizione molecolare costituisce la base strutturale di molti composti, in cui l'ordinamento viene effettuato in modo tale che ogni ione rimanga al centro di una figura ottaedrica, come mostrato nell'immagine seguente.
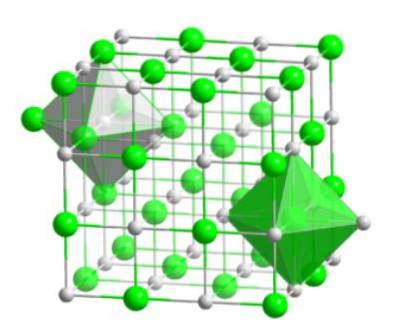
In questo tipo di cristallo si può osservare come ciascuno degli ioni abbia intorno altri sei ioni - che hanno carica elettrica opposta - che si trovano alle estremità della figura ottaedrica..
Allo stesso modo, la struttura di questa sostanza ionica implica che abbia un alto punto di fusione di circa 747 ° C, trovandosi in commercio nelle sue due forme: una specie anidra (senza molecole d'acqua) e una specie diidrata (con due molecole d'acqua nella sua struttura formula (NaBr 2HDueO)), i cui punti di fusione sono diversi.
Sintesi chimica
Il bromuro di sodio ha origine dalla reazione chimica che avviene tra il bromuro di idrogeno (BrH, un alogenuro di idrogeno in fase gassosa) e l'idrossido di sodio (NaOH, una base forte in fase solida e con proprietà igroscopiche).
In questo modo viene prodotto commercialmente, aggiungendo un eccesso di bromo a una soluzione di NaOH. Si forma così una miscela bromuro / bromo. Successivamente, i prodotti risultanti vengono sottoposti ad evaporazione fino a essiccazione, e vengono trattati con carbone per generare la reazione di riduzione dello ione bromato (BrO3-) allo ione bromuro (Br-).
Neutralizzazione
Allo stesso modo, questo sale inorganico può anche essere prodotto attraverso una reazione di neutralizzazione del carbonato di sodio (NaDueCO3) con acido bromico (HBrO3), seguendo la stessa procedura sopra descritta.
Attraverso una sintesi è possibile produrre questa sostanza attraverso la reazione tra il ferro con il bromo e l'acqua. Come prodotto di questa reazione, ha origine la specie di bromuro ferroso ferrico.
Successivamente, questa specie si è formata (rappresentata come FeBrDue/ FeBr3) viene sciolto in acqua e ad esso viene aggiunta una certa quantità di carbonato di sodio. Infine, la soluzione viene filtrata e passa attraverso un processo di evaporazione per ottenere finalmente il bromuro di sodio..
Proprietà
- Si trova comunemente in uno stato solido di aggregazione, sotto forma di polvere bianca.
- Ha una struttura cristallina, con una disposizione molecolare a forma di cubo centrata sulle facce.
- Il punto di fusione di questa sostanza è di circa 747 ° C per la sua forma anidra e 36 ° C per la sua forma diidrata, presentando decomposizione prima della fusione..
- È costituito da uno ione sodio (Na+) e uno ione bromuro (Br-), con una massa molare o un peso molecolare di 102,89 g / mol.
- Il suo punto di ebollizione è piuttosto alto, osservato a 1390 ° C (equivalente a 2530 ° F o 1660 K).
- La solubilità di questa specie è di circa 94,32 g / 100ml in acqua a 25 ° C, aumentando con l'aumentare della temperatura..
- Quando riscaldata al punto in cui si decompone, questa sostanza rilascia gas di bromo e ossido di sodio che sono considerati tossici..
- La densità della forma anidra del bromuro di sodio è di 3,21 g / cm3, mentre quella del composto diidrato è di 2,18 g / cm3.
- La sua solubilità in alcool è considerata moderata, come in altri solventi come piridina, ammoniaca e idrazina.
- Presenta insolubilità contro acetonitrile e acetone.
Applicazioni
- In medicina è usato come farmaco per un gran numero di condizioni che causano convulsioni e come terapia per prevenire l'epilessia nei pazienti con sindrome di Wolf-Hirschhorn, nonché nei trattamenti sedativi e ipnotici..
- In medicina veterinaria viene utilizzato nei cani che presentano disturbi convulsivi dovuti agli effetti collaterali di farmaci come il primidone o il fenobarbital.
- Nel campo dell'industria petrolifera, viene utilizzato nei processi di preparazione di alcuni fluidi di varia densità che vengono utilizzati nei pozzi petroliferi..
- Nell'area della ricerca biologica, le sue proprietà microbiocide sono state dimostrate; cioè, è usato per controllare lo sviluppo di diversi tipi di batteri.
- In alcune sintesi di tipo organico, questo sale inorganico viene utilizzato per la preparazione di altre specie costituite da bromo. Ad esempio, mediante la reazione di Finkelstein si ottengono alcuni alogenuri alchilici a maggiore reattività, uno dei quali era ampiamente utilizzato in fotografia..
- Nell'area di pulizia e disinfezione, il bromuro di sodio viene utilizzato in combinazione con il cloro per la sanificazione di grandi volumi di acqua, come nelle piscine e nelle vasche idromassaggio..
Riferimenti
- Wikipedia. (s.f.). Bromuro di sodio. Estratto da en.wikipedia.org
- PubChem. (s.f.). Bromuro di sodio. Estratto da pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Invito alla chimica organica. Recupero da books.google.co.ve
- Science Direct. (s.f.). Bromuro di sodio. Estratto da sciencedirect.com
- Riviere, J. E. e Papich, M. G. (2009). Farmacologia e terapia veterinaria. Recupero da books.google.co.ve



Nessun utente ha ancora commentato questo articolo.