
Storia, struttura, configurazione elettronica, proprietà, usi del bromo
Il bromo È un elemento non metallico che appartiene al gruppo degli alogeni, gruppo 17 (VIIA) della tavola periodica. Il suo simbolo chimico è Br. Si presenta come una molecola biatomica, i cui atomi sono legati da un legame covalente, per il quale è assegnata la formula molecolare BrDue.
A differenza del fluoro e del cloro, il bromo in condizioni terrestri non è un gas ma un liquido bruno-rossastro (immagine sotto). Sta fumando ed è insieme al mercurio, gli unici elementi liquidi. Sotto di esso, lo iodio, sebbene intensifichi il suo colore e diventi viola, può cristallizzare in un solido volatile.

Il bromo fu scoperto indipendentemente nel 1825 da Carl Löwig, che studiava sotto la direzione del chimico tedesco Leopold Gmelin; e nel 1826 dal chimico francese Antoine-Jérome Balard. Tuttavia, la pubblicazione dei risultati sperimentali di Balard ha preceduto quella di Löwig..
Il bromo è il 62 ° elemento più abbondante sulla Terra, essendo distribuito a basse concentrazioni in tutta la crosta terrestre. In mare la concentrazione media è di 65 ppm. Il corpo umano contiene lo 0,0004% di bromo e la sua funzione non è nota in modo definitivo..
Questo elemento è sfruttato commercialmente in salamoie o luoghi che, per particolari condizioni, sono luoghi di elevata concentrazione di sali; ad esempio il Mar Morto, a cui convergono le acque dei territori limitrofi, sature di sali.
È un elemento corrosivo in grado di attaccare metalli, come platino e palladio. Dissolto in acqua, il bromo può esercitare la sua azione corrosiva anche sui tessuti umani, aggravando la situazione perché si può generare acido bromidrico. Per quanto riguarda la sua tossicità, può causare danni significativi agli organi, come fegato, reni, polmoni e stomaco.
Il bromo è molto dannoso nell'atmosfera, essendo 40-100 volte più distruttivo per lo strato di ozono rispetto al cloro. La metà della perdita dello strato di ozono in Antartide è prodotta da reazioni legate al bromometile, un composto usato come fumigante.
Ha numerosi usi, come: ritardante di fiamma, agente sbiancante, disinfettante per superfici, additivo per carburanti, intermedio nella produzione di sedativi, nella produzione di prodotti chimici organici, ecc..
Indice articolo
- 1 Storia
- 1.1 Il lavoro di Carl Löwig
- 1.2 Il lavoro di Antoine Balard
- 2 Struttura e configurazione elettronica del bromo
- 2.1 Molecola
- 2.2 Cristalli
- 2.3 Strato di valenza e stati di ossidazione
- 3 Proprietà
- 3.1 Aspetto fisico
- 3.2 Peso atomico
- 3.3 numero atomico
- 3.4 Odore
- 3.5 Punto di fusione
- 3.6 Punto di ebollizione
- 3.7 Liquido a densità (Br2)
- 3.8 Solubilità in acqua
- 3.9 Solubilità
- 3.10 Punto triplo
- 3.11 Punto critico
- 3.12 Calore di fusione (Br2)
- 3.13 Calore di vaporizzazione (Br2)
- 3.14 Capacità termica molare (Br2)
- 3.15 Pressione di vapore
- 3.16 Temperatura di autoaccensione
- 3.17 Punto di infiammabilità
- 3.18 Temperatura di conservazione
- 3.19 Tensione superficiale
- 3.20 Soglia di odore
- 3.21 Indice di rifrazione (ηD)
- 3.22 Elettronegatività
- 3.23 Energia di ionizzazione
- 3.24 Raggio atomico
- 3.25 Raggio covalente
- 3.26 Raggio di Van der Waals
- 3.27 Reattività
- 4 Usi
- 4.1 Additivo per benzina
- 4.2 Pesticidi
- 4.3 Controllo delle emissioni di mercurio
- 4.4 Fotografia
- 4.5 Azioni terapeutiche
- 4.6 Ignifugo
- 4.7 Additivo alimentare
- 4.8 Reagenti e intermedio chimico
- 4.9 Azione biologica
- 5 Dove trovare
- 6 Rischi
- 7 Riferimenti
Storia
Il lavoro di Carl Löwig
Il bromo fu scoperto indipendentemente e quasi contemporaneamente da Carl Jacob Löwig, un chimico tedesco nel 1825, e da Antoine Balard, un chimico francese nel 1826..
Carl Löwig, un discepolo del chimico tedesco Leopold Gmelin, raccolse l'acqua da una sorgente a Bad Kreuznach e vi aggiunse il cloro; dopo l'aggiunta dell'etere, la miscela liquida è stata agitata.
Quindi, l'etere è stato distillato e concentrato per evaporazione. Di conseguenza ha ottenuto una sostanza bruno-rossastra, che era il bromo.
Il lavoro di Antoine Balard
Balard, da parte sua, utilizzava le ceneri di un'alga bruna nota come fucus e le mescolava con la salamoia, estratta dalle saline di Montpellier. Così, ha rilasciato il bromo, facendo passare il cloro attraverso il materiale acquoso sottoposto ad estrazione, in cui era presente il bromuro di magnesio, MgBr.Due.
Successivamente, il materiale è stato distillato in presenza di biossido di manganese e acido solforico, producendo vapori rossi che si sono condensati in un liquido scuro. Balard pensava fosse un elemento nuovo e lo chiamò muride, derivato dalla parola latina muria, con la quale veniva designata salamoia.
È stato notato che Balard cambiò il nome da muride a brôme su suggerimento di Anglada o Gay-Lussac, basato sul fatto che brôme significa fallo, che definisce l'odore dell'elemento scoperto..
I risultati furono pubblicati da Belard negli Annales of Chemie and Physique, prima che Löwig pubblicasse il suo.
Solo a partire dal 1858 fu possibile produrre bromo in quantità significative; anno in cui furono scoperti e sfruttati i depositi di sale di Stassfurt, che produssero il bromo come sottoprodotto della potassa.
Struttura e configurazione elettronica del bromo
Molecola

L'immagine in alto mostra la molecola di bromo, BrDue, con un modello di riempimento compatto. In realtà, c'è un semplice legame covalente tra i due atomi di bromo, Br-Br.
Essendo una molecola omogenea e biatomica, manca di un momento di dipolo permanente e può interagire con altre dello stesso tipo solo per mezzo delle forze di dispersione di Londra..
Questo è il motivo per cui il suo liquido rossastro è fumante; in molecole BrDue, sebbene relativamente pesanti, le loro forze intermolecolari li tengono insieme liberamente.
Il bromo è meno elettronegativo del cloro e quindi ha un effetto meno attraente sugli elettroni nei gusci di valenza. Di conseguenza, richiede meno energia per viaggiare a livelli di energia più elevati, assorbendo i fotoni verdi e riflettendo un colore rossastro..
Cristalli
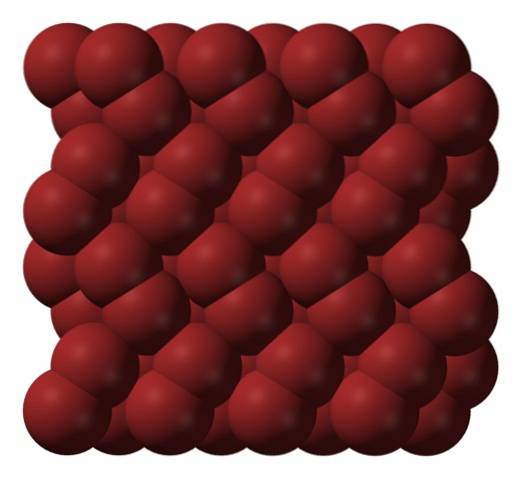
Nella fase gassosa, le molecole BrDue si separano notevolmente fino a quando non ci sono interazioni efficienti tra di loro. Tuttavia, al di sotto del suo punto di fusione, il bromo può congelare in cristalli ortorombici rossastri (immagine in alto).
Nota come le molecole BrDue sono disposti ordinatamente in modo tale da sembrare "vermi di bromo". Qui ea queste temperature (T < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Strato di valenza e stati di ossidazione
La configurazione elettronica del bromo è:
[Ar] 3d104sDue 4p5
Essere 3d104sDue 4p5 il suo guscio di valenza (sebbene l'orbitale 3d10 non svolgono un ruolo di primo piano nelle loro reazioni chimiche). Gli elettroni negli orbitali 4s e 4p sono i più esterni e si sommano fino a un totale di 7, solo un elettrone dal completamento dell'ottetto di valenza.
Da questa configurazione si possono dedurre i possibili stati di ossidazione del bromo: -1, se guadagna un elettrone per essere isoelettronico a krypton; +1, rimanendo come 3d104sDue 4p4; +3, +4 e +5, perdendo tutti gli elettroni dall'orbitale 4p ([Ar] 3d104sDue4p0); e +7, senza lasciare elettroni nell'orbitale 4s ([Ar] 3d104s04p0).
Proprietà
Aspetto fisico
Liquido fumante bruno-rossastro scuro. Si trova in natura come molecola biatomica, con gli atomi legati da un legame covalente. Il bromo è un liquido più denso dell'acqua e vi affonda.
Peso atomico
79,904 g / mol.
Numero atomico
35.
Odore
Un fumo pungente, soffocante e irritante.
Punto di fusione
-7,2 ºC.
Punto di ebollizione
58.8 ºC.
Densità (BrDue) liquido
3.1028 g / cm3
Solubilità dell'acqua
33,6 g / L a 25 ° C. La solubilità del bromo in acqua è bassa e tende ad aumentare al diminuire della temperatura; comportamento simile ad altri gas.
Solubilità
Facilmente solubile in alcool, etere, cloroformio, tetracloruro di carbonio, disolfuro di carbonio e acido cloridrico concentrato. Solubile in solventi non polari e alcuni solventi polari come alcool, acido solforico e molti solventi alogenati.
Punto triplo
Da 265,9 K a 5,8 kPa.
Punto critico
588 K a 10,34 MPa.
Calore di fusione (BrDue)
10.571 kJ / mol.
Calore di vaporizzazione (BrDue)
29,96 kJ / mol.
Capacità termica molare (BrDue)
75,69 kJ / mol.
Pressione del vapore
Ad una temperatura di 270 K, 10 kPa.
Temperatura di autoaccensione
Non infiammabile.
punto di accensione
113 ºC.
Temperatura di conservazione
Da 2 a 8 ºC.
Tensione superficiale
40,9 mN / ma 25 ºC.
Soglia di odore
0,05-3,5 ppm. 0,39 mg / m3
Indice di rifrazione (ηD)
1.6083 a 20 ºC e 1.6478 a 25 ºC.
Elettronegatività
2.96 della scala Pauling.
Energia ionizzata
- Primo livello: 1.139,9 kJ / mol.
- Secondo livello: 2.103 kJ / mol.
- Terzo livello: 3.470 kJ / mol.
Radio atomica
120 pm.
Raggio covalente
120.3 pm.
Radio Van der Waals
185 pm.
Reattività
È meno reattivo del cloro, ma più reattivo dello iodio. È un ossidante meno forte del cloro e più forte dello iodio. È anche un agente riducente più debole dello iodio, ma più forte del cloro..
Il vapore di cloro è altamente corrosivo per molti materiali e tessuti umani. Attacca molti elementi metallici, inclusi platino e palladio; ma non attacca piombo, nichel, magnesio, ferro, zinco e sotto i 300 ºC né il sodio.
Il bromo nell'acqua subisce un cambiamento e si trasforma in bromuro. Può anche esistere come bromato (BrO3-), a seconda del pH del liquido.
Per la sua azione ossidante, il bromo può indurre il rilascio di radicali liberi dell'ossigeno. Questi sono forti ossidanti e possono causare danni ai tessuti. Inoltre, il bromo può infiammarsi spontaneamente se combinato con potassio, fosforo o stagno..
Applicazioni
Additivo per benzina
Il dibromuro di etilene è stato utilizzato per rimuovere potenziali depositi di piombo dai motori delle automobili. Dopo la combustione della benzina, che utilizzava il piombo come additivo, il bromo combinato con il piombo formava il bromuro di piombo, un gas volatile che veniva espulso attraverso il tubo di scarico..
Sebbene il bromo rimuovesse il piombo dalla benzina, la sua azione distruttiva sullo strato di ozono era molto potente, motivo per cui è stato scartato per questa applicazione.
Pesticidi
Il metilene o bromometil bromuro è stato utilizzato come pesticida per purificare i terreni, in particolare per eliminare i nematodi parassiti, come l'anchilostoma..
Tuttavia, l'uso della maggior parte dei composti contenenti bromo è stato scartato a causa della loro azione distruttiva sullo strato di ozono..
Controllo delle emissioni di mercurio
Il bromo viene utilizzato in alcuni impianti per ridurre l'emissione di mercurio, un metallo molto tossico..
Fotografia
Il bromuro d'argento, oltre allo ioduro d'argento e al cloruro d'argento, viene utilizzato come composto sensibile alla luce nelle emulsioni fotografiche.
Azioni terapeutiche
Il bromuro di potassio, così come il bromuro di litio, sono stati usati come sedativi generali nel XIX e all'inizio del XX secolo. I bromuri sotto forma di sali semplici sono ancora utilizzati in alcuni paesi come anticonvulsivanti.
Tuttavia, la FDA statunitense non approva oggi l'uso del bromo per il trattamento di alcuna malattia..
Ignifugo
Il bromo viene trasformato dalle fiamme in acido bromidrico, che interferisce con la reazione di ossidazione che si verifica durante l'incendio e ne provoca l'estinzione. I polimeri contenenti bromo vengono utilizzati per produrre resine ignifughe.
Additivo alimentare
Alla farina sono state aggiunte tracce di bromato di potassio per migliorare la cottura.
Reagenti e intermedio chimico
Il bromuro di idrogeno viene utilizzato come agente riducente e catalizzatore per reazioni organiche. Il bromo è utilizzato come intermedio chimico nella produzione di farmaci, fluidi idraulici, agenti refrigeranti, deumidificatori e nei preparati per arricciare i capelli.
Trova anche impiego nella produzione di fluidi di perforazione di pozzi, prodotti per la disinfezione dell'acqua, agenti sbiancanti, disinfettanti per superfici, coloranti, additivi per carburanti, ecc..
Azione biologica
Uno studio condotto nel 2014 indica che il bromo è un cofattore necessario per la biosintesi del collagene IV, che rende il bromo un elemento essenziale per lo sviluppo dei tessuti animali. Tuttavia, non ci sono informazioni sulle conseguenze di un deficit dell'elemento.
Dove si trova
Il bromo viene estratto commercialmente dalle miniere di sale e dalle fosse profonde della salamoia che si trovano nello stato dell'Arkansas e nel Great Salt Lake dello Utah, entrambi negli Stati Uniti. Quest'ultima salamoia ha una concentrazione di bromo dello 0,5%.
Per estrarre il bromo, il cloro gassoso caldo viene aggiunto alla salamoia per ossidare gli ioni bromuro nella soluzione, raccogliendo il bromo elementare..
Il Mar Morto, al confine tra Giordania e Israele, è un mare chiuso che si trova sotto il livello del mare, il che gli fa avere un'altissima concentrazione di sali.
Il bromo e la potassa si ottengono lì commercialmente, facendo evaporare l'acqua ad alto contenuto di sale del Mar Morto. In questo mare la concentrazione di bromo può raggiungere i 5 g / L.
Si trova anche in alte concentrazioni in alcune sorgenti termali. La brominite, ad esempio, è un minerale di bromuro d'argento che si trova in Bolivia e in Messico..
Rischi
Il bromo allo stato liquido è corrosivo per i tessuti umani. Ma il pericolo maggiore per l'uomo deriva dai vapori di bromo e dalla loro inalazione..
Respirare in un ambiente con una concentrazione di bromo di 11-23 mg / m3 produce gravi shock. Una concentrazione di 30-60 mg / m3 è estremamente dannoso. Nel frattempo, una concentrazione di 200 mg può essere fatale.
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Bromo. Database PubChem. CID = 23968. Estratto da: pubchem.ncbi.nlm.nih.gov
- Ross Rachel. (8 febbraio 2017). Fatti sul bromo. Estratto da: livesscience.com
- Wikipedia. (2019). Borace. Estratto da: en.wikipedia.org
- Lenntech B. V. (2019). Bromo. Estratto da: lenntech.com


Nessun utente ha ancora commentato questo articolo.