
Struttura, proprietà, usi del boroidruro di sodio (NaBH4)

Il boroidruro di sodio è un solido inorganico la cui formula chimica è NaBH4. Può essere considerato rappresentativo degli alcali boroidridi ed è il più comune di questi. È un solido cristallino bianco.
A contatto con l'acqua, NaBH4 può generare calore e idrogeno HDue che è combustibile, quindi deve essere maneggiato con cautela. Per la facilità con cui può generare ioni idruro H-, Il boroidruro di sodio è un composto moderatamente riducente, quindi è ampiamente utilizzato nelle reazioni chimiche per questo scopo.

La sua proprietà riducente è utilizzata anche nell'industria della carta, poiché migliora le caratteristiche di brillantezza e stabilità della pasta di legno e della carta agendo contro l'ossidazione della cellulosa, componente principale della carta..
Poiché può facilmente formare idrogeno in presenza di acqua, è stata anche studiata la possibilità di utilizzarlo come fonte reversibile di idrogeno nelle celle a combustibile..
Ha altri usi tutti basati sulla sua proprietà riducente, come nell'industria farmaceutica.
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà fisiche
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Temperatura di autoaccensione
- 3.4 Temperatura di decomposizione
- 3.5 Densità
- 3.6 Solubilità
- 4 Proprietà chimiche
- 5 Rischi
- 6 Ottenimento
- 7 Usi
- 7.1 Nelle reazioni chimiche di riduzione
- 7.2 Nella produzione di H2 nelle celle a combustibile
- 7.3 Nell'industria della pasta di legno e della carta
- 7.4 In vari usi
- 8 Riferimenti
Struttura
Il boroidruro di sodio è un composto ionico. È formato dall'anione boroidruro [BH4]- attaccato al catione di sodio Na+.
L'anione [BH4]- è tetraedrico.
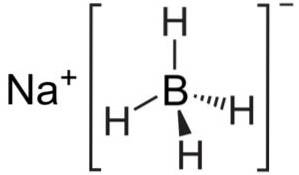
La sua struttura di Lewis è la seguente:
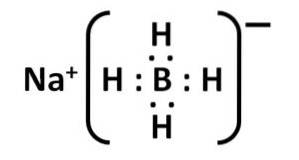
Nomenclatura
-Boroidruro di sodio
-Tetraidroborato di sodio
-Tetraidruroborato di sodio
Proprietà fisiche
Stato fisico
Solido bianco cristallino.
Peso molecolare
37,84 g / mol
Temperatura di autoaccensione
∼ 220 ºC
temperatura di decomposizione
> 250 ºC
Densità
1.074 g / cm3 a 20 ºC
Solubilità
Il NaBH4 è abbastanza solubile in acqua (55 g / 100mL a 25 ºC), dove è parzialmente idrolizzato. È solubile in tetraidrofurano (THF) ed è insolubile in etere dietilico.
Proprietà chimiche
Il boroidruro di sodio si dissolve in acqua, dove subisce una decomposizione iniziale o idrolisi che rende la soluzione basica, prevenendo un'ulteriore idrolisi..
[BH4]- + HDueO → B (OH)3 + HDue↑ + OH-
Ciò è spiegato perché [BH4]- interagisce con l'H+ dell'acqua, dove l'H+ prende un anione idruro H- per formare HDue. Si può dire che il BH3 competere con l'H+ dallo ione idruro H-.
In un mezzo acido l'idrolisi è completa a causa dell'abbondanza di ioni H.+.
Il NaBH4 è stabile all'aria secca. Non è volatile.
A causa del suo contenuto di ioni idruro, il boroidruro di sodio è un composto riducente. Permette di ridurre il gruppo carbonile C = O a C-OH, cioè i composti carbonilici ad alcoli.
Il NaBH4 Di per sé non riduce i doppi legami C = C, nemmeno quelli coniugati con gruppi carbonilici -C = C-C (= O)-.
Tuttavia, a contatto con acidi protonici (come HCl) o acidi di Lewis (come BCl3 o AlCl3) si forma il diborano B.DueH6. E se questa reazione viene condotta in presenza di composti organici con doppi legami C = C, il diborano BDueH6 esegue l'idroborazione di questi.
In presenza di catalizzatori appropriati e condizioni specifiche, il boroidruro di sodio può ridurre vari tipi di gruppi funzionali.
Rischi
Il calore della reazione di idrolisi in acqua è sufficiente per accendere l'idrogeno che si forma in essa. Quindi è importante prestare attenzione quando lo si maneggia.
Il NaBH4 si accende facilmente e brucia facilmente.
Ottenere
La tipica reazione di preparazione NaBH4 è attraverso l'idruro di sodio NaH e B (OCH3)3 ad una temperatura di circa 250 ºC:
4 NaH + B (OCH3)3 → NaBH4 + 3 NaOCH3
Applicazioni
Nelle reazioni chimiche di riduzione
Perché è una fonte di ioni H.-, il NaBH4 È un composto riducente e viene utilizzato per preparare altri composti chimici. Per questo viene utilizzato in solventi polari aprotici, cioè senza protoni H.+, come dimetilsolfossido, esametilfosforammide e dimetilformammide.
È usato come agente riducente nelle reazioni chimiche sia organiche che inorganiche..
Permette di ridurre le aldeidi ad alcoli primari e chetoni ad alcoli secondari.
Riduce anche gli alogenuri alchilici a idrocarburi come lo iododecano a decano, l'acido bromoundecanoico ad acido undecanoico e il clorododecano a dodecano..
Se agisce da solo, durante la riduzione non influenza altri gruppi funzionali come estere, acido carbossilico, nitrile e solfone.
La sua proprietà di non ridurre i doppi legami C = C, nemmeno quelli coniugati con i gruppi carbonilici -C = C-C (= O) -, permette di preparare alcoli insaturi -C = C-CHDue-Oh.
Per ridurre i composti aromatici nitrati alle loro aniline corrispondenti è necessaria la presenza di catalizzatori come il cobalto o il cloruro di stagno. Riduce i disolfuri a tioli.
In presenza di opportune condizioni e catalizzatori permette di ridurre acidi carbossilici, esteri, ammidi, nitrili, immine, epossidi e anche doppi e tripli legami.
Nella produzione di HDue nelle celle a combustibile
Il NaBH4 può essere convertito in una cella a combustibile.
Il NaBH4 in presenza di una soluzione alcalina di KOH o NaOH idrolizza e produce idrogeno HDue che può essere utilizzato come combustibile in una cella a combustibile elettrolitica polimerica.
È stato anche studiato come materiale di stoccaggio per H.Due reversibilmente.
Le nanoparticelle NaBH vengono sintetizzate4 e stabilizzato con un tensioattivo. Dopo il trattamento con NiClDue si forma uno strato o rivestimento protettivo che regola il rilascio di H.Due completamente reversibile.
Questo nuovo materiale nanometrico consentirebbe l'uso di H.Due come combustibile pulito e rinnovabile.

Nell'industria della cellulosa e della carta
Il boroidruro di sodio viene utilizzato per migliorare la lucentezza e altre proprietà fisiche della polpa e della carta..
La degradazione della matrice cellulosica della carta avviene attraverso processi complessi che comportano l'ossidazione. I gruppi idrossilici vengono ossidati a carbonile e carbossile, questo porta allo scolorimento della carta e ad una diminuzione delle sue proprietà fisiche..
Quando si tratta polpa o carta con NaBH4, Questo riduce aldeidi e chetoni a gruppi -OH senza influenzare i gruppi carbossilici acidi, migliorando stabilità e brillantezza a valori superiori a quelli iniziali..

In vari usi
Il boroidruro di sodio è usato per trattare le acque reflue, come agente esaltatore di sapidità nell'industria alimentare e delle bevande, come agente di rivestimento e per il trattamento delle superfici, nella produzione di tabacco, nell'industria farmaceutica, tessile e industriale..
Riferimenti
- Christian, M.L. e Aguey-Zinsou, K.-F. (2012). Strategia core-shell che porta a un'elevata capacità di stoccaggio dell'idrogeno reversibile per NaBH4. ACS Nano 2012, 6, 9, 7739-7751. Recuperato da pubs.acs.org.
- Nora de Souza, M.V. e Alves V., T.R. (2006). Metodologie recenti mediate dal sodio boroidruro nella riduzione di diverse classi di composti. App. Organometal. Chem.2006; 20: 798-810. Recupero da onlinelibrary.wiley.com.
- Imamoto, T. (1991). Riduzione. Boroidruro di sodio. In sintesi organica completa. Recupero da sciencedirect.com.
- Tang, L.C. (1986) Stabilizzazione della carta attraverso il trattamento con boroidruro di sodio. In tessuti storici e materiali cartacei. Capitolo 24. Pagine 427-441. Advances in Chemistry, Volume 212. Recovered from pubs.acs.org.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Morrison, Robert Thornton; e Boyd, Robert Neilson. 1992. Chimica organica. Prentice-Hall. ISBN 81-203-0765-8.
- NOI. Biblioteca nazionale di medicina. (2019). Boroidruro di sodio. Estratto da: pubchem.ncbi.nlm.nih.gov.



Nessun utente ha ancora commentato questo articolo.