
Struttura, nomenclatura, proprietà, usi dell'ossido di ferro (III)

Il ossido di ferro (III) L'ossido ferrico è un solido inorganico formato dalla reazione di ferro (Fe) e ossigeno (ODue), in cui si ottiene uno stato di ossidazione del ferro di +3. La sua formula chimica è FeDueO3.
In natura si trova principalmente sotto forma del minerale ematite, che deve il suo nome al colore rosso delle sue strisce. L'ematite è il principale minerale di ferro per uso industriale.

Il colore e l'aspetto di FeDueO3 dipendono dalle dimensioni e dalla forma delle sue particelle, dall'identità e dalla quantità di impurità e acqua presenti. Si conoscono i pigmenti giallo, arancio e rosso. Non ha lucentezza metallica.
Non conduce elettricità, ma miscelato con altri ossidi può produrre vetri semiconduttori. La forma cristallina alfa è antiferromagnetica e la gamma è ferromagnetica.
È usato come pigmento rosso in vernici, gomme, ceramiche e carta. Anche in rivestimenti protettivi per acciaio e altri metalli. La sua versatilità è dovuta alla sua tingibilità e potere coprente, alla sua resistenza alla luce ultravioletta e agli alcali..
Viene utilizzato nella preparazione di granati o pietre fini di vari ossidi metallici. Viene utilizzato per lucidare vetro, diamanti e metalli preziosi (grado di gioielleria). È anche usato come catalizzatore in varie reazioni. È stato utilizzato per il trattamento delle acque reflue.
Indice articolo
- 1 Struttura
- 1.1 Alpha
- 1.2 Gamma
- 1.3 Beta ed Epsilon:
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Densità
- 3.5 Solubilità
- 3.6 Altre proprietà
- 4 Usi
- 4.1 Nel settore delle costruzioni
- 4.2 In pitture e rivestimenti
- 4.3 Nell'industria della plastica e della gomma
- 4.4 In vetro e gioielli
- 4.5 Su materiale di registrazione magnetica
- 4.6 Nell'industria alimentare, farmaceutica e cosmetica
- 4.7 Nella catalisi delle reazioni chimiche
- 4.8 Nella riduzione del riscaldamento globale
- 4.9 Altri usi
- 5 Riferimenti
Struttura
Alfa
La forma cristallina α-FeDueO3 ha la struttura del corindone (minerale AlDueO3), dove gli ioni ossido (O-Due) formano strati impaccati esagonali, con ioni Fe+3 occupando i due terzi dei siti ottaedrici.
In altre parole, ogni fede+3 è circondato ottaedralmente da 6 ioni O-Due. Il suo colore cambia con l'aumentare della dimensione delle particelle dal rosso vivo al viola scuro.
Gamma
Γ-FeDueO3 presenta una struttura simile a uno spinello con una disposizione cubica di impaccamento di ioni ossido, con ioni Fe+3 distribuiti casualmente tra gli interstizi ottaedrici e tetraedrici. Questa varietà cristallina, se riscaldata in aria a più di 400 ºC, cambia nella struttura alfa. Ha un colore marrone.
Beta ed Epsilon:
Sono rare forme cristalline di questo ossido. Β-FeDueO3 cristallizza in un sistema romboedrico. Questa struttura è metastabile e quando riscaldata al di sopra di circa 500 ºC si trasforma nella varietà alfa..
Il ε-FeDueO3 cristallizza ortorombica. È anche metastabile ea temperature comprese tra 230 e 500 ºC passa nella struttura alfa..
Nomenclatura
Ematite: minerale naturale FeDueO3 che cristallizza nella forma alfa. È anche noto come specularite o oligisto.

Maghemite o ematite magnetica: forma gamma di FeDueO3, poco abbondante in natura.

Ossido ferrico: FedeDueO3.
Ossidi di ferro (III) naturali: Sono quelli che si trovano in natura. Sono stati utilizzati fin dalla preistoria, ad esempio, nei dipinti delle grotte di Altamira.
Ossidi di ferro sintetico (III): Si preparano sinteticamente, ottenendo una composizione che corrisponde a quella dei minerali naturali. Sono preferiti ai naturali per la loro tonalità o tonalità pura, proprietà coerenti e capacità di colorazione..
Proprietà
Stato fisico
Solido, la cui colorazione può essere rosso luminoso, bruno rossastro e viola scuro a seconda della struttura cristallina e della dimensione delle particelle.
Peso molecolare
159,69 g / mol.
Punto di fusione
1566 ºC.
Densità
5,24 g / cm3
Solubilità
Insolubile in acqua, solubile in acido cloridrico (HCl) e acido solforico (H.DueSW4).
Altre proprietà
- Gli ossidi di ferro (III) si caratterizzano per la loro bassa intensità di colore, per l'ottima resistenza ai raggi ultravioletti, per la tingibilità e per l'ottimo potere coprente..
- Sono atossici, resistenti al colore e poco costosi.
- Sono resistenti agli alcali. Non reagiscono con acidi deboli o basi deboli. Se non sono contaminati da manganese (Mn), non reagiscono con i solventi organici.
- La forma alfa è paramagnetica (è attratta dai magneti, ma non diventa un materiale magnetizzato permanentemente) o antiferromagnetica. È un isolante elettrico.
- La forma gamma è ferromagnetica. Ciò significa che quando sottoposti a un campo magnetico, vengono disposti i dipoli magnetici del materiale, che rimane per un certo tempo dopo aver eliminato il campo magnetico..
Applicazioni
Nel settore delle costruzioni
I pigmenti di ossido di ferro (III) sono ampiamente utilizzati per colorare il cemento e altri materiali da costruzione: piastrelle in calcestruzzo, mattoni per pavimentazione, cemento fibroso, bitume o malta, tra gli altri..

Questo utilizzo si basa sul fatto che non influenzano il tempo di presa, la forza di compressione o la resistenza alla trazione del cemento o di altri materiali..
Può essere incorporato in molti leganti grazie alla sua tonalità di colore puro, buon potere coprente, buona resistenza all'abrasione e bassa tendenza a sedimentare.
In vernici e rivestimenti
A causa della loro resistenza agli acidi e alle basi, vengono utilizzati come pigmenti in pitture e vernici. La loro resistenza alle alte temperature le rende ottime negli smalti.
I pigmenti sintetici a base di ematite sono utilizzati nei rivestimenti di protezione dalla corrosione, in particolare quelli marini. La sua struttura cristallina ritarda la penetrazione dell'umidità e delle sostanze corrosive presenti nel salnitro.
Protegge bene su rivestimenti per interni, esterni e parti metalliche. Nella manutenzione e ridipintura di ponti, il suo utilizzo porta alla protezione da umidità, rugiada o nebbia densa, e ad una facile asciugatura a basse temperature ambiente.
Utilizzato anche nella carta da parati.
Nell'industria della plastica e della gomma
Gli ossidi di ferro (III) sono usati per colorare le plastiche e le gomme. Gli ossidi di ferro sintetico (III) sono preferiti in questa applicazione. Sebbene gli ossidi di ferro naturale (III) siano più economici, il loro uso è diminuito rispetto ai sintetici.
In vetro e gioielli
Sono anche utilizzati nella lucidatura di vetro, metalli preziosi, diamanti e pietre preziose..
Servono anche come coloranti nella produzione di occhiali.
Su materiale di registrazione magnetica
La forma gamma è stata utilizzata come materiale magnetico nella produzione di supporti di registrazione magnetici, ad esempio, nei sistemi di archiviazione delle informazioni come cassette audio e video, negli studi di trasmissione, nei floppy disk, nei nastri per computer e nei dischi rigidi o software dei computer..
In tale applicazione, la dimensione delle particelle è estremamente importante per garantire buone proprietà magnetiche. Il livello di rumore nei nastri magnetici diminuisce al diminuire della dimensione delle particelle.
Anche la loro resistenza all'attrito è importante, poiché i floppy disk hanno uno strato magnetico in cui si trovano particelle di maghemite e il loro tempo di utilizzo utile dipende dalla capacità di detto strato di resistere all'attrito..
I composti polimerici magnetici sono stati preparati con nanoparticelle di γ-FeDueO3, per l'uso in interferenze elettromagnetiche e dispositivi di assorbimento a microonde.
Nell'industria alimentare, farmaceutica e cosmetica
I pigmenti a base di ossidi di ferro sintetico (III) prodotti da materiali di partenza puri sono considerati non tossici..
Per questo possono essere utilizzati come coloranti in prodotti alimentari, farmaceutici e cosmetici..
Nella catalisi delle reazioni chimiche
Gli ossidi di ferro (III) sono usati come catalizzatori o basi di catalizzatori in vari processi chimici.
Insieme all'acetato di cellulosa, sono stati testati come supporto per nanoparticelle metalliche da utilizzare come catalizzatori nella degradazione di composti organici tossici che inquinano le acque reflue..
Per la loro capacità di assorbire la luce dallo spettro visibile, sono stati proposti per la fotocatalisi nella fotodegradazione dell'inquinamento organico..
Nella riduzione del riscaldamento globale
L'ematite è stata studiata come assorbente nell'anidride carbonica (CODue). Si sta studiando se questo possa aiutare a risolvere il problema degli effetti del riscaldamento globale prodotto dall'alta concentrazione di CODue nell'atmosfera.
Altri usi
- Grazie alla sua capacità di adsorbimento, FeDueO3 Viene utilizzato nella produzione di sensori di fluoro o altri gas e nei rilevatori di umidità.
- Mescolato con altri ossidi, viene utilizzato nella produzione di cristalli semiconduttori..
- È stato utilizzato come potenziatore delle proprietà elettrochimiche nelle batterie al litio ricaricabili.
Riferimenti
- Elementi americani (2019). Ossido di ferro (III). Recuperato da americanelements.com.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. John Wiley & Sons.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Volume 14 e 19. Quarta edizione. John Wiley & Sons.
- Enciclopedia della chimica industriale di Ullmann. (1990). Volume A20. Quinta edizione. VCH. Verlagsgessellschaft mbH.
- Castaño, J.G. e Arroyave, C. (1998). La funzionalità degli ossidi di ferro. Metallo. Madrid, 34 (3), 1998. Recupero da revistademetalurgia.revistas.csic.es
- Esraa M. Bakhsh, Shahid Ali Khan, Hadi M. Marwani, Ekram Y. Danish, Abdullah M. Asiri, Sher Bahadar Khan. (2017). Prestazioni di catalizzatori metallici supportati da nanocompositi di acetato di cellulosa-ossido ferrico per la riduzione degli inquinanti ambientali. Giornale internazionale delle macromolecole biologiche. DOI: 10.1016 / j.ijbiomac.2017.09.034
- Mora Mendoza, E.Y. et al. (2019). Ossidi di ferro come assorbenti efficienti per la cattura della CO2. Journal of Materials Research and Technology. 2019, 8 (3): 2944-2956. Recupero da sciencedirect.com.
- Piao Xu, et al. (2012). Uso di nanomateriali di ossido di ferro nel trattamento delle acque reflue: una revisione. Science of the Total Environment 424 (2012) 1-10. Recupero da sciencedirect.com.


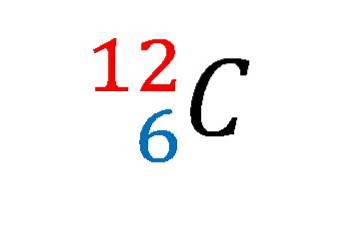
Nessun utente ha ancora commentato questo articolo.