
Fondazione, preparazione e utilizzo dell'agar EMB
Il Agar EMB è un terreno di coltura solido selettivo e differenziale utilizzato per l'isolamento di bacilli Gram negativi, principalmente della famiglia delle Enterobacteriaceae, e di altri bacilli Gram negativi non esigenti. È anche conosciuto con l'acronimo EAM, che sta per eosina-metilene blu..
Questo terreno è stato creato da Holt-Harris e Teague nel 1916. Contiene peptone, lattosio, saccarosio, fosfato dipotassico, agar, eosina, blu di metilene e acqua. È molto simile a MacConkey Agar, soprattutto quando si utilizza l'agar EMB modificato di Levine, che non contiene saccarosio.
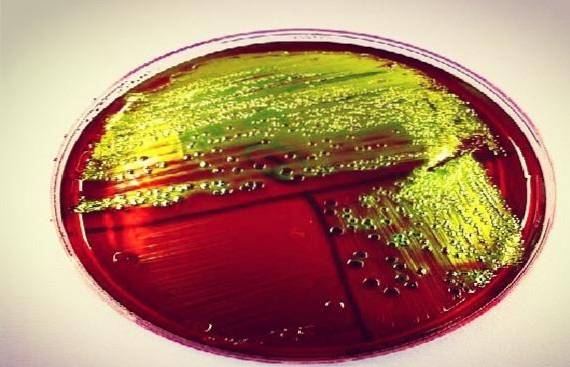
Ogni laboratorio, infatti, decide se lavorare con l'uno o con l'altro, poiché svolgono la stessa funzione, anche se biochimicamente sono diversi..
Ha anche lo stesso inconveniente del classico agar MacConkey in termini di produzione brulicante del genere Proteus. Pertanto, per evitare questo fenomeno, la concentrazione di agar può essere aumentata fino al 5%..
Indice articolo
- 1 Razionale
- 1.1 Selettivo
- 1.2 Differenziale
- 2 Preparazione
- 3 usi
- 4 Controllo di qualità
- 5 Considerazioni finali
- 6 Riferimenti
Base
Selettivo
L'agar EMB è sottilmente selettivo perché contiene i coloranti all'anilina (eosina e blu di metilene), che agiscono come inibitori, prevenendo la crescita della maggior parte dei batteri Gram positivi e di alcuni bastoncini Gram negativi esigenti..
Tuttavia, questo agar ha lo svantaggio che alcuni batteri Gram positivi possono resistere alla presenza di sostanze inibitorie e crescere come piccole colonie puntiformi incolori, come Enterococcus faecalis e alcuni Stafilococco.
Possono crescere anche alcuni lieviti, come Complesso di Candida albicans, che darà colonie rosa molto piccole. Le clamidospore possono anche svilupparsi da questo lievito se il campione è seminato in profondità..
Differenziale
D'altra parte, l'agar EMB è anche un mezzo differenziale, poiché questi coloranti insieme (eosina e blu di metilene) hanno la proprietà di formare un precipitato a pH acido, quindi servono come indicatori della sua produzione..
Pertanto, i batteri che fermentano debolmente il lattosio o il saccarosio producono colonie viola entro 24-48 ore. Ad esempio i generi Klebsiella, Enterobacter e Serratia.
Quei batteri che fermentano fortemente il lattosio, come Escherichia coli, o saccarosio, come Yersinia enterocolitica o Proteus penneri, formano un precipitato nero-verdastro, che conferisce a queste specie una caratteristica lucentezza metallica.
Va notato che se si utilizza il terreno EMB levine (senza saccarosio), Yersinia enterocolitica Y Proteus penneri produrrà colonie chiare.
I batteri che non fermentano il lattosio o il saccarosio sono nutriti dalla presenza di peptoni, che forniscono gli amminoacidi e l'azoto necessari per la crescita batterica e producono colonie chiare. Ad esempio, i generi Salmonella e Shigella, tra gli altri.
Allo stesso modo, è importante notare che il genere Acinetobacter può presentare colonie blu lavanda, anche se non è un fermentatore di lattosio o saccarosio, ma ha la proprietà di fissare il blu di metilene sulla sua parete cellulare. Questo può accadere anche con altri batteri ossidativi.
Preparazione
Il terreno disidratato originale è di colore beige chiaro.
Per preparare questo terreno di coltura, è necessario pesare 36 grammi del terreno disidratato e sospenderli in un pallone contenente un litro di acqua distillata..
Dopo aver lasciato riposare il composto per 5 minuti, portare il matraccio su una fonte di calore, mescolando energicamente e costantemente fino a quando bolle e si scioglie completamente..
Successivamente, il terreno di coltura già disciolto deve essere sterilizzato utilizzando l'autoclave a 121 ° C per 15 minuti..
Al termine del tempo viene tolto dall'autoclave e lasciato riposare brevemente. Quindi, ancora caldo (45-50 ° C), 15-20 ml di agar vengono serviti in ciascuna piastra Petri sterile. Il mezzo dovrebbe essere tornasole blu.
Dopo aver servito i piatti si lasciano leggermente scoperti finché l'agar non si raffredda leggermente. Vengono quindi coperti e lasciati solidificare completamente. Successivamente vengono ordinati in portapiatti capovolti e conservati in frigorifero (8 ° C) fino al momento dell'uso..
Questa procedura è preferibilmente eseguita in una cappa a flusso laminare o davanti al becco Bunsen per evitare contaminazioni.
È importante tenere presente che ogni casa commerciale indicherà la quantità da pesare per preparare il terreno di coltura..
Il pH finale del mezzo deve essere 7,2 ± 0,2
Applicazioni
Questo terreno viene utilizzato per seminare urine e feci o qualsiasi tipo di campione clinico, soprattutto se si sospetta la presenza di bacilli Gram-negativi non esigenti, come i bacilli appartenenti alla famiglia delle Enterobacteriaceae, che crescono molto bene su questo terreno..
I batteri enteropatogeni dei generi Shigella e Salmonella si distinguono per le loro colonie incolori o leggermente ambrate.
Crescono anche altri bacilli non fermentanti il lattosio come Aeromonas, Pseudomonas, Acinetobacter, tra gli altri..
Allo stesso modo, questo terreno è molto utile nell'analisi microbiologica di cibo e acqua, poiché è ideale per la fase di conferma completa della determinazione dei coliformi, cioè per confermare la presenza di E. coli da brodi CE torbidi, dalla tecnica del numero più probabile (MPN).
QA
Per verificare che il terreno di coltura appena preparato funzioni bene, è possibile piantare ceppi di controllo per osservare le caratteristiche delle colonie e verificare che diano come previsto..
Per questo, ceppi ATCC o ceppi ben identificati di E. coli, Enterobacter aerogenes, Klebsiella sp, Salmonella typhimurium, Shigella flexneri, Pseudomonas aeruginosa e alcuni batteri Gram positivi, come S. aureus.
Ci si aspetta che E. coli Genera colonie nere bluastre ben sviluppate con lucentezza metallica verde. Mentre, Enterobacter aerogenes Y Klebsiella sp dovrebbero dare colonie mucose nero-bluastre ben sviluppate.
Da parte sua, Salmonella typhimurium Y Shigella flexneri, dovrebbe sviluppare colonie grandi, incolori o leggermente ambrate.
Infine il genere Pseudomonas aeruginosa cresce come colonie incolori di dimensioni irregolari, mentre i batteri Gram positivi dovrebbero essere totalmente inibiti o crescere scarsamente con colonie molto piccole.
Pensieri finali
A volte la sterilizzazione provoca la riduzione del blu di metilene, che mostra un colore arancione medio. Affinché il blu di metilene si ossidi e recuperi il colore viola, deve essere miscelato delicatamente fino a quando il colore non viene ripristinato..
Inoltre, dopo la sterilizzazione, il colorante può precipitare, quindi deve essere miscelato bene prima di servire le piastre di Petri..
Riferimenti
- Camacho A, Giles M, Ortegón A, Palao M, Serrano B e Velázquez O. 2009. Tecniche per l'analisi microbiologica degli alimenti. 2a ed. Facoltà di Chimica, UNAM. Messico.
- Carranza C, León R, Falcón N, Neumann A, Kromm C.Caratterizzazione e distribuzione dei ceppi di Escherichia coli Potenzialmente patogeno isolato da polli da carne provenienti da allevamenti avicoli in Perù. Rev. investiga. veterinario. Perù 2012 23 (2): 209-219. Disponibile su: scielo.org.
- Laboratorios Conda S.A. Eosina e agar blu di metilene. 2010, disponibile su: condalab.com
- Britannia Laboratories. Levine E.M.B (With Eosin and Methylene Blue) 2011, disponibile su: britanialab.com
- BD Laboratories. BD EMB Agar (Eosin Methylene Blue Agar), modificato. 2013, disponibile su: bd.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosi microbiologica. (5a ed.). Argentina, Editoriale Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott Microbiological Diagnosis. 12 ed. Argentina. Editoriale Panamericana S.A


Nessun utente ha ancora commentato questo articolo.