
Variazione elettronica di affinità nella tavola periodica e negli esempi
Il Affinità elettronica o l'elettroaffinità è una misura della variazione energetica di un atomo nella fase gassosa quando incorpora un elettrone nel suo guscio di valenza. Una volta che l'elettrone è stato acquisito dall'atomo A, l'anione risultante A- può o non può essere più stabile del tuo stato di base. Pertanto, questa reazione può essere endotermica o esotermica..
Per convenzione, quando il guadagno elettronico è endotermico, al valore di affinità elettronica viene assegnato un segno positivo "+"; Se invece è esotermico, cioè rilascia energia, a questo valore viene dato un segno negativo "-". In quali unità sono espressi questi valori? In kJ / mol o in eV / atomo.
Se l'elemento fosse in una fase liquida o solida, i suoi atomi interagirebbero tra loro. Ciò farebbe sì che l'energia assorbita o rilasciata, a causa del guadagno elettronico, venga dispersa tra tutte queste, producendo risultati inaffidabili..
D'altra parte, nella fase gassosa si presume che siano isolati; in altre parole, non interagiscono con nulla. Quindi, gli atomi coinvolti in questa reazione sono: A (g) e A-(g). Qui (g) denota che l'atomo è in fase gassosa.
Indice articolo
- 1 Prima e seconda affinità elettronica
- 1.1 Primo
- 1.2 Secondo
- 2 Come varia l'affinità elettronica nella tavola periodica
- 2.1 Variazione del nucleo e dell'effetto schermante
- 2.2 Variazione per configurazione elettronica
- 3 esempi
- 3.1 Esempio 1
- 3.2 Esempio 2
- 4 Riferimenti
Prima e seconda affinità elettroniche
Primo
La reazione del guadagno elettronico può essere rappresentata come:
A (g) + e- => A-(g) + E, o come A (g) + e- + E => A-(g)
Nella prima equazione, E (energia) si trova come prodotto sul lato sinistro della freccia; e nella seconda equazione l'energia è conteggiata come reattiva, essendo situata sul lato destro. Cioè, il primo corrisponde a un guadagno elettronico esotermico e il secondo a un guadagno elettronico endotermico.
Tuttavia, in entrambi i casi è solo un elettrone che viene aggiunto al guscio di valenza dell'atomo A..
Secondo
È anche possibile che, una volta formato lo ione negativo A-, assorbe di nuovo un altro elettrone:
PER-(g) + e- => ADue-(g)
Tuttavia, i valori per la seconda affinità elettronica sono positivi, poiché le repulsioni elettrostatiche tra lo ione negativo A devono essere superate- e l'elettrone in arrivo e-.
Cosa determina che un atomo gassoso "riceva" meglio un elettrone? La risposta si trova essenzialmente nel nucleo, nell'effetto schermante degli strati elettronici interni e nello strato di valenza.
Come varia l'affinità elettronica nella tavola periodica
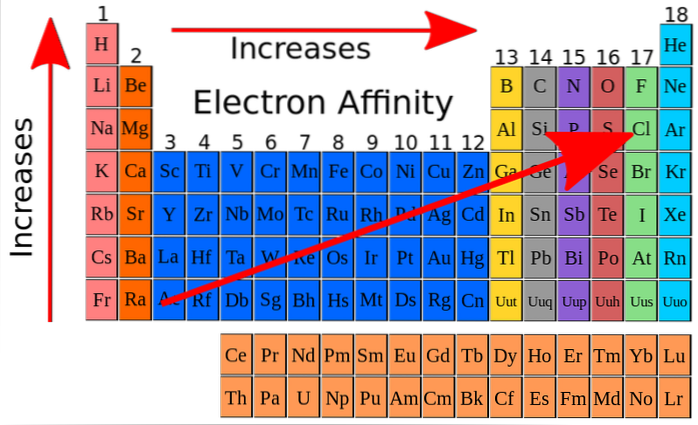
Nell'immagine in alto, le frecce rosse indicano le direzioni in cui aumenta l'affinità elettronica degli elementi. Da ciò l'affinità elettronica può essere intesa come una delle proprietà periodiche in più, con la particolarità che presenta molte eccezioni.
L'affinità elettronica aumenta ascendendo attraverso i gruppi e aumenta anche da sinistra a destra lungo la tavola periodica, specialmente in prossimità dell'atomo di fluoro. Questa proprietà è strettamente correlata al raggio atomico e ai livelli di energia dei suoi orbitali..
Variazione per nucleo e effetto schermante
Il nucleo ha protoni, che sono particelle caricate positivamente che esercitano una forza attrattiva sugli elettroni nell'atomo. Più gli elettroni sono vicini al nucleo, maggiore è l'attrazione che provano. Pertanto, all'aumentare della distanza dal nucleo agli elettroni, minori sono le forze attrattive..
Inoltre, gli elettroni del guscio interno aiutano a "schermare" l'effetto del nucleo sugli elettroni dei gusci più esterni: gli elettroni di valenza..
Ciò è dovuto alle stesse repulsioni elettroniche tra le loro cariche negative. Tuttavia, questo effetto viene contrastato aumentando il numero atomico Z.
In che modo quanto sopra si riferisce all'affinità elettronica? Che un atomo gassoso A avrà una maggiore tendenza a guadagnare elettroni e formare ioni negativi stabili quando l'effetto schermante è maggiore delle repulsioni tra l'elettrone in arrivo e quelli del guscio di valenza.
L'opposto si verifica quando gli elettroni sono molto lontani dal nucleo e le repulsioni tra loro non minano il guadagno elettronico..
Ad esempio, la discesa in un gruppo "apre" nuovi livelli di energia, che aumentano la distanza tra il nucleo e gli elettroni esterni. È per questo motivo che quando si sale attraverso i gruppi aumentano le affinità elettroniche.
Variazione per configurazione elettronica
Tutti gli orbitali hanno i loro livelli di energia, quindi se il nuovo elettrone occuperà un orbitale di maggiore energia, l'atomo dovrà assorbire energia affinché ciò sia possibile..
Inoltre, il modo in cui gli elettroni occupano gli orbitali può o meno favorire il guadagno elettronico, distinguendo così le differenze tra gli atomi..
Ad esempio, se tutti gli elettroni sono spaiati negli orbitali p, l'inclusione di un nuovo elettrone causerà la formazione di una coppia appaiata, che esercita forze repulsive sugli altri elettroni..
È il caso dell'atomo di azoto, la cui affinità elettronica (8kJ / mol) è inferiore a quella dell'atomo di carbonio (-122kJ / mol).
Esempi
Esempio 1
La prima e la seconda affinità elettronica per l'ossigeno è:
O (g) + e- => O-(g) + (141kJ / mol)
O-(g) + e- + (780kJ / mol) => ODue-(g)
La configurazione elettronica per O è 1sDue2sDue2 P4. Esiste già una coppia accoppiata di elettroni, che non può superare la forza di attrazione del nucleo; pertanto, il guadagno elettronico rilascia energia dopo che si è formato lo ione O stabile.-.
Tuttavia, sebbene ODue- Ha la stessa configurazione del neon a gas nobile, le sue repulsioni elettroniche superano la forza attrattiva del nucleo, e per consentire l'ingresso dell'elettrone è necessario un contributo energetico.
Esempio 2
Se si confrontano le affinità elettroniche degli elementi del gruppo 17, si otterrà quanto segue:
F (g) + e- = F-(g) + (328 kJ / mol)
Cl (g) + e- = Cl-(g) + (349 kJ / mol)
Br (g) + e- = Br-(g) + (325 kJ / mol)
Io (g) + e- = I-(g) + (295 kJ / mol)
Dall'alto verso il basso - discendendo nel gruppo - aumentano i raggi atomici, così come la distanza tra il nucleo e gli elettroni esterni. Ciò causa un aumento delle affinità elettroniche; tuttavia, il fluoro, che dovrebbe avere il valore più alto, è superato dal cloro.
Perché? Questa anomalia dimostra l'effetto delle repulsioni elettroniche sulla forza di attrazione e sulla bassa schermatura..
Poiché è un atomo molto piccolo, il fluoro "condensa" tutti i suoi elettroni in un piccolo volume, provocando una maggiore repulsione sull'elettrone in arrivo, a differenza dei suoi congeneri più voluminosi (Cl, Br e I)..
Riferimenti
- Chemistry LibreTexts. Affinità elettronica. Estratto il 4 giugno 2018 da: chem.libretexts.org
- Jim Clark. (2012). Affinità elettronica. Estratto il 4 giugno 2018 da: chemguide.co.uk
- Carl R. Nave. Affinità elettroniche degli elementi del gruppo principale. Estratto il 4 giugno 2018 da: hyperphysics.phy-astr.gsu.edu
- Prof. N. De Leon. Affinità elettronica. Estratto il 4 giugno 2018 da: iun.edu
- Helmenstine, Anne Marie, Ph.D. (27 maggio 2016). Definizione di affinità elettronica. Estratto il 4 giugno 2018 da: thoughtco.com
- Cdang. (3 ottobre 2011). Tavola periodica di affinità elettronica. [Figura]. Estratto il 4 giugno 2018 da: commons.wikimedia.org
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). CENGAGE Learning, p. 227-229.
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione., P. 29). Mc Graw Hill.



Nessun utente ha ancora commentato questo articolo.