
Struttura, funzione, recettori, meccanismo d'azione dell'adiponectina
Il adiponectina è una delle proteine secretorie più abbondanti prodotte da un particolare tipo di cellule note come adipociti, caratteristiche del tessuto adiposo. È responsabile dell'aumento della sensibilità all'insulina ed è coinvolto nell'omeostasi energetica e nell'obesità.
Il gene dell'adiponectina umana è stato clonato dal tessuto adiposo nel 1996, durante gli esperimenti di Matsuzawa, che lo ha definito il più abbondante gene adiposo trascritto-1 (apM1). trascritto del gene adiposo più abbondante 1).
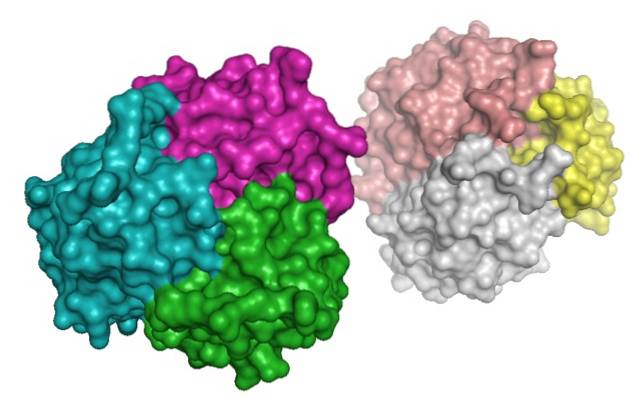
La proteina, d'altra parte, è stata identificata nel plasma sanguigno quello stesso anno da Nakano et al..
Questo ormone contribuisce all'integrazione dei segnali endocrini e metabolici legati al controllo dell'omeostasi energetica. La sua espressione è indotta durante la differenziazione degli adipociti e circola nel siero a concentrazioni relativamente elevate..
Indice articolo
- 1 Struttura
- 2 Funzione
- 3 ricevitori
- 3.1 T-caderina
- 4 Meccanismo d'azione
- 5 Valori normali
- 6 Riferimenti
Struttura
L'adiponectina appartiene alla famiglia del complemento 1q (C1q) e può essere trovata nel plasma sanguigno in un'ampia varietà di complessi multimerici (di diverse subunità): trimeri, esameri e multimeri ad alto peso molecolare (di oltre 18 subunità).
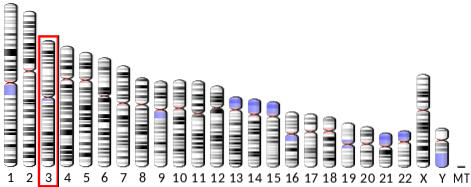
Il gene che codifica per l'adiponectina (ADIPOQ) si trova sul braccio lungo del cromosoma 3 nell'uomo, ha 16 chilogrammi di basi e 3 esoni. La sua espressione produce una proteina idrosolubile, composta da 247 residui di amminoacidi e un peso molecolare di poco inferiore a 30 kDa, con un punto isoelettrico di 5,42.
È costituito da quattro domini: una sequenza di segnali all'estremità N-terminale, una regione variabile, un dominio di collagene (cAd) e un dominio C-terminale globulare..
Nella porzione amminoterminale si distingue una sequenza simile al collagene nota come dominio del collagene, che è una regione di grande importanza per la formazione di multimeri ed è altamente conservata tra le specie.
L'idrossilazione e la concomitante glicosilazione dei residui di lisina nel dominio del collagene di questa proteina è ciò che consente la formazione di trimeri, che allo stesso tempo possono associarsi tra loro per formare esameri e altri complessi ad alto peso molecolare..
Questi complessi apparentemente hanno una specificità tissutale "bersaglio", ad esempio i complessi ad alto peso molecolare sono più attivi nel fegato, mentre trimeri ed esameri agiscono senza molta distinzione in un'ampia varietà di tessuti..
La regione globulare al C-terminale, chiamata dominio globulare o gAd, è omologa a proteine come il collagene VIII e il collagene X, nonché il fattore del complemento C1q..
Funzione
In termini generali, si ritiene che l'ormone adiponectina agisca in modo rilevante nella regolazione del metabolismo dei lipidi e dei carboidrati in vari tessuti insulino-sensibili..
Questo agisce su diversi tessuti del corpo, poiché i suoi recettori sono espressi in più punti. Prodotto esclusivamente dagli adipociti, l'adiponectina promuove la biosintesi degli acidi grassi e l'inibizione della gluconeogenesi nel fegato, uno dei tessuti dove si trova il suo recettore AdipoR2..
Nel muscolo scheletrico, dove si trovano i recettori AdipoR1 e AdipoR2, favorisce l'ossidazione degli acidi grassi e l'ingresso del glucosio nelle cellule muscolari.
L'adiponectina migliora anche la resistenza all'insulina in alcuni pazienti, poiché riduce la quantità di grasso intracellulare attivando l'ossidazione degli acidi grassi sia nel muscolo che nel fegato..
Alcuni autori suggeriscono che questo ormone agisca anche come antiossidante, come agente antinfiammatorio e come fattore anti-arteriosclerotico.
Ricevitori
I diversi complessi di adiponectina sembrano avere una certa preferenza su tessuti specifici. Queste interazioni tessuto-specifiche si verificano in risposta all'espressione differenziale di diversi tipi di recettori dell'adiponectina..
I recettori dell'adiponectina (AdipoR) sono recettori accoppiati a proteine G appartenenti alla famiglia dei recettori noti come PAQR. Sono noti due tipi: AdipoR1 e AdipoR2. Entrambi mantengono i loro domini N-terminale nello spazio intracellulare, mentre i loro domini C-terminale sono esposti verso lo spazio extracellulare..
I recettori di tipo AdipoR1 hanno 375 aminoacidi e 42 kDa di peso molecolare, mentre i recettori di tipo AdipoR2 hanno 311 aminoacidi e un peso di 35 kDa. Entrambi hanno 7 domini transmembrana, cioè la loro struttura attraversa la membrana plasmatica delle cellule dove si trovano 7 volte..
Esiste circa il 70% di omologia di sequenza tra entrambi i recettori, ad eccezione delle loro estremità N-terminali, che sono specifiche per ciascuno di essi..
Sia AdipoR1 che AdipoR2 sono espressi in tutti i tessuti, anche se la loro abbondanza varia da uno all'altro. AdipoR1 è principalmente nel muscolo scheletrico e AdipoR2 è sia nel muscolo scheletrico che nel fegato.
T-caderina
Esiste anche un recettore "putativo" per l'adiponectina noto come T-caderina, che consiste in una singola molecola di caderina che ha perso i suoi domini citosolici e transmembrana ed è legata alla superficie cellulare attraverso ancore di glicosilfosfatidilinositolo (ancore GPI).
Questo “recettore” dell'adiponectina è espresso in tutti i tessuti, ma è stato segnalato con maggiore abbondanza nel cuore, nelle arterie aortica, carotide, iliaca e nelle arterie renali..
Meccanismo di azione
Sebbene i meccanismi di produzione e rilascio di adiponectina nel flusso sanguigno non siano completamente compresi, si ritiene che il percorso di trasduzione del segnale inizi con il legame dell'adiponectina ai recettori di membrana sulle sue cellule bersaglio..
Questo ormone induce l'attivazione della protein chinasi attivata da AMP (AMPK), che avviene attraverso una proteina "adattatore" che contiene un dominio di omologia con pleckstrin (tipico delle proteine coinvolte nei processi di segnalazione cellulare) e un dominio di legame alla fosfotirosina (PTB) , più un motivo di chiusura leucina 1 (APPL).
Il dominio APPL è quello che si lega alla porzione intracellulare di uno dei due recettori AdipoR. Una piccola proteina GTPasi nota come Rab5 si lega a uno dei siti del dominio di chiusura della leucina e promuove la traslocazione di membrana di GLUT4, un trasportatore di glucosio regolato dall'insulina..
Inoltre, l'adiponectina agisce su un fattore di trascrizione nucleare noto come PPARα, importante dal punto di vista del metabolismo delle proteine, dei lipidi e dei carboidrati, nonché della differenziazione e dello sviluppo cellulare..
Valori normali
I valori normali riportati per l'adiponectina nel plasma sanguigno corrispondono a complessi multimerici di questa proteina, il cui range di concentrazione è compreso tra 5 e 20 microgrammi per millilitro, sebbene siano state documentate anche concentrazioni fino a 30 microgrammi per millilitro..
Considerando quanto sopra, vale la pena ricordare che le concentrazioni di adiponectina nel plasma variano in modo significativo; le donne, ad esempio, tendono ad avere valori più alti rispetto agli uomini.
I valori di questo ormone dipendono molto dallo stato nutrizionale, dalla presenza o assenza di qualsiasi patologia, ecc., Ma sono generalmente inversamente correlati con l'adiposità e con condizioni quali malattie cardiovascolari, ipertensione e sindromi metaboliche.
Esistono rapporti che assicurano che le concentrazioni plasmatiche di adiponectina diminuiscano in quei pazienti che soffrono di condizioni patologiche come l'insulino-resistenza e l'obesità.
Riferimenti
- Chandran, M., Phillips, S. A., Ciaraldi, T. e Henry, R. R. (2003). Adiponectina: più di un semplice ormone delle cellule adipose? Cura del diabete, 26 (8), 2442-2450.
- Hirako, S. (2016). Adiponectina. In Handbook of Hormones (pp. 308-e34B). Stampa accademica.
- Kadowaki, T. e Yamauchi, T. (2005). Recettori dell'adiponectina e dell'adiponectina. Revisioni endocrine, 26 (3), 439-451.
- Kadowaki, T., Yamauchi, T., Kubota, N., Hara, K., Ueki, K. e Tobe, K. (2006). Recettori dell'adiponectina e dell'adiponectina nella resistenza all'insulina, nel diabete e nella sindrome metabolica. The Journal of Clinic Investigation, 116 (7), 1784-1792.
- Klein, S., & Romijn, J. A. (2007). Capitolo 35-Obesità. Williams Textbook of Endocrinology, 11, 1568-1569.
- Steyn, F. J., e Chen, C. (2013). Adiponectina.


Nessun utente ha ancora commentato questo articolo.