
Struttura, proprietà, sintesi, usi dell'etile acetato
Il acetato di etile o etanoato di etile (Nome IUPAC) è un composto organico la cui formula chimica è CH3COOCDueH5. È costituito da un estere, dove la componente alcolica deriva dall'etanolo, mentre la sua componente di acido carbossilico proviene dall'acido acetico..
È un liquido in normali condizioni di temperatura e pressione, che presenta un gradevole profumo fruttato. Questa proprietà è perfettamente in armonia con quanto ci si aspetta da un estere; che è in effetti la natura chimica dell'acetato di etile. Per questo trova impiego nei prodotti alimentari e nelle bevande alcoliche..

L'immagine in alto mostra la struttura scheletrica dell'acetato di etile. Notare a sinistra la sua componente acido carbossilico, ea destra la componente alcolica. Da un punto di vista strutturale, ci si può aspettare che questo composto si comporti come un ibrido tra aceto e alcol; tuttavia, mostra le sue proprietà.
È qui che tali ibridi chiamati esteri si distinguono per essere diversi. L'acetato di etile non può reagire come un acido, né può essere disidratato a causa dell'assenza di un gruppo OH. Invece, subisce l'idrolisi basica in presenza di una base forte, come l'idrossido di sodio, NaOH.
Questa reazione di idrolisi viene utilizzata nei laboratori didattici per esperimenti cinetici chimici; dove anche la reazione è di secondo ordine. Quando si verifica l'idrolisi, l'etanoato di etile ritorna praticamente ai suoi componenti iniziali: acido (deprotonato da NaOH) e alcol.
Nel suo scheletro strutturale si osserva che gli atomi di idrogeno predominano sugli atomi di ossigeno. Ciò influenza la loro capacità di interagire con specie che non sono polari come i grassi. Allo stesso modo, viene utilizzato per sciogliere composti come resine, coloranti e in generale solidi organici..
Nonostante abbia un aroma gradevole, l'esposizione prolungata a questo liquido ha un impatto negativo (come quasi tutti i composti chimici) sul corpo..
Indice articolo
- 1 Struttura dell'acetato di etile
- 1.1 Assenza di atomi donatori di legami idrogeno
- 2 Proprietà fisiche e chimiche
- 2.1 Nomi
- 2.2 Formula molecolare
- 2.3 Peso molecolare
- 2.4 Descrizione fisica
- 2.5 Colore
- 2.6 Odore
- 2.7 Aroma
- 2.8 Soglia di odore
- 2.9 Punto di ebollizione
- 2.10 Punto di fusione
- 2.11 Solubilità in acqua
- 2.12 Solubilità in solventi organici
- 2.13 Densità
- 2.14 Densità del vapore
- 2.15 Stabilità
- 2.16 Pressione di vapore
- 2.17 Viscosità
- 2.18 Calore di combustione
- 2.19 Calore di vaporizzazione
- 2.20 Tensione superficiale
- 2.21 Indice di rifrazione
- 2.22 Temperatura di conservazione
- 2.23 pKa
- 3 Sintesi
- 3.1 reazione di Fisher
- 3.2 reazione di Tishchenko
- 3.3 Altri metodi
- 4 Usi
- 4.1 Solvente
- 4.2 Aromi artificiali
- 4.3 Analitica
- 4.4 Sintesi organiche
- 4.5 Cromatografia
- 4.6 Entomologia
- 5 Rischi
- 6 Riferimenti
Struttura dell'acetato di etile
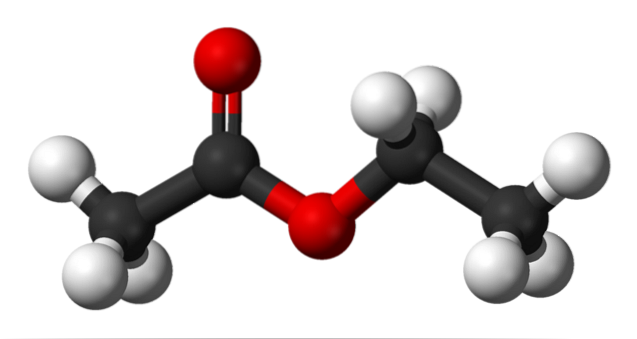
L'immagine in alto mostra la struttura dell'acetato di etile con un modello di sfere e barre. In questo modello, gli atomi di ossigeno sono evidenziati con sfere rosse; alla sua sinistra è la frazione derivata dall'acido, e alla sua destra la frazione derivata dall'alcol (gruppo alcossilico, -OR).
Il gruppo carbonile è visto dal legame C = O (le doppie barre). La struttura attorno a questo gruppo e all'ossigeno adiacente è piatta, a causa del fatto che c'è una delocalizzazione della carica per risonanza tra i due ossigeni; un fatto che spiega un'acidità relativamente bassa degli idrogeni α (quelli del gruppo -CH3, legato a C = O).
Ruotando due dei suoi legami, la molecola favorisce direttamente il modo in cui interagisce con le altre molecole. La presenza dei due atomi di ossigeno e l'asimmetria nella struttura gli conferiscono un momento di dipolo permanente; che a sua volta è responsabile delle loro interazioni dipolo-dipolo.
Ad esempio, la densità elettronica è maggiore vicino ai due atomi di ossigeno, diminuendo notevolmente nel gruppo -CH.3, e gradualmente nel gruppo OCHDueCH3.
A causa di queste interazioni, le molecole di acetato di etile formano un liquido in condizioni normali, che ha un punto di ebollizione considerevolmente alto (77 ° C)..
Assenza di atomi donatori di legami idrogeno
Se osservi attentamente la struttura, noterai l'assenza di un atomo in grado di donare un legame idrogeno. Tuttavia, gli atomi di ossigeno sono tali accettori e, a causa dell'etile acetato, è molto solubile in acqua e interagisce in misura stimabile con composti polari e donatori di legami idrogeno (come gli zuccheri)..
Inoltre, questo gli consente di interagire in modo eccellente con l'etanolo; motivo per cui la sua presenza non manca nelle bevande alcoliche.
D'altra parte, il suo gruppo alcossilico lo rende in grado di interagire con alcuni composti apolari, come il cloroformio, CH3Cl.
Proprietà fisiche e chimiche
Nomi
-Acetato di etile
-Etanoato di etile
-Estere etilico acetico
-Acetossietano
Formula molecolare
C4H8ODue o CH3COOCDueH5
Peso molecolare
88,106 g / mol.
Descrizione fisica
Liquido limpido incolore.
Colore
Liquido incolore.
Odore
Caratteristico degli eteri, simile all'odore dell'ananas.
Gusto
Piacevole quando diluito, aggiunge un sapore fruttato alla birra.
Soglia di odore
3,9 ppm. 0,0196 mg / m3 (basso odore); 665 mg / m3 (odore intenso).
Odore rilevabile a 7-50 ppm (media = 8 ppm).
Punto di ebollizione
Da 171ºF a 760 mmHg (77,1ºC).
Punto di fusione
-118,5ºF (-83,8ºC).
Solubilità dell'acqua
80 g / L.
Solubilità in solventi organici
Miscibile con etanolo ed etere etilico. Molto solubile in acetone e benzene. Miscibile anche con cloroformio, oli fissi e volatili, e anche con solventi ossigenati e clorurati.
Densità
0.9003 g / cm3.
Densità del vapore
3.04 (in aria: rapporto 1).
Stabilità
Si decompone lentamente con l'umidità; incompatibile con varie plastiche e forti agenti ossidanti. La miscelazione con l'acqua può essere esplosiva.
Pressione del vapore
93,2 mmHg a 25 ºC
Viscosità
0,423 m Rumore a 25 ºC.
Calore di combustione
2.238,1 kJ / mol.
Calore di vaporizzazione
35,60 kJ / mol a 25 ºC.
Tensione superficiale
24 dine / cm a 20 ° C.
Indice di rifrazione
1.373 a 20 ºC / D.
Temperatura di conservazione
2 - 8 ºC.
pKa
16 - 18 a 25 ºC.
Sintesi
Reazione di Fisher
L'acetato di etile viene sintetizzato industrialmente dalla reazione di Fisher, in cui l'etanolo viene esterificato con acido acetico. La reazione viene condotta a temperatura ambiente.
CH3CHDueOH + CH3COOH <=> CH3COOCHDueCH3 + HDueO
La reazione è accelerata dalla catalisi acida. L'equilibrio si sposta verso destra, cioè verso la produzione di acetato di etile, attraverso la rimozione dell'acqua; secondo la Legge dell'Azione di Massa.
Reazione di Tishchenko
Anche l'acetato di etile viene preparato industrialmente utilizzando la reazione di Tishchenko, coniugando due equivalenti di acetaldeide con l'uso di un alcossido come catalizzatore..
2 CH3CHO => CH3COOCHDueCH3
Altri metodi
-L'etile acetato viene sintetizzato come coprodotto nell'ossidazione del butano ad acido acetico, in una reazione condotta ad una temperatura di 175ºC e 50 atm di pressione. È usato come catalizzatore per ioni cobalto e cromo.
-L'acetato di etile è un sottoprodotto dell'etanolisi di acetato di polivinile in alcol polivinilico.
-L'etilacetato viene prodotto anche nell'industria attraverso la deidrogenazione dell'etanolo, catalizzando la reazione attraverso l'uso del rame ad alta temperatura, ma inferiore a 250 ºC..
Applicazioni
Solvente
L'acetato di etile viene utilizzato come solvente e diluente, utilizzato nella pulizia dei circuiti stampati. È usato come solvente nella produzione di estratto di luppolo modificato e nella decaffeinizzazione del caffè e delle foglie di tè. Viene utilizzato negli inchiostri utilizzati per contrassegnare frutta e verdura.
L'acetato di etile è utilizzato nell'industria tessile come agente di pulizia. Viene utilizzato nella taratura dei termometri, utilizzato nella separazione degli zuccheri. Nell'industria delle vernici viene utilizzato come solvente e diluente per i materiali utilizzati..
Aromi artificiali
Viene utilizzato nella produzione di aromi alla frutta; ad esempio: banana, pera, pesca e ananas, oltre all'aroma dell'uva, ecc..
Analytics
Viene utilizzato nella determinazione di bismuto, boro, oro, molibdeno e platino, nonché come solvente per tallio. L'etile acetato ha la capacità di estrarre molti composti ed elementi presenti in soluzione acquosa, quali: fosforo, cobalto, tungsteno e arsenico.
Sintesi organiche
L'acetato di etile viene utilizzato nell'industria come riduttore di viscosità per le resine utilizzate nelle formulazioni di fotoresist. Utilizzato nella produzione di acetammide, acetato di acetato e metil eptanone.
Cromatografia
L'acetato di etile viene utilizzato nei laboratori come fase mobile della cromatografia su colonna e come solvente di estrazione. Poiché l'acetato di etile ha un punto di ebollizione relativamente basso, è facile da evaporare, consentendo di concentrare le sostanze disciolte nel solvente.
Entomologia
L'etile acetato viene utilizzato in entomologia per soffocare gli insetti posti in un contenitore, consentendone la raccolta e lo studio. I vapori di acetato di etile uccidono l'insetto senza distruggerlo e impedendone l'indurimento, facilitandone l'assemblaggio per la raccolta..
Rischi
-Il LDcinquanta di acetato di etile nei ratti indica una bassa tossicità. Tuttavia, può irritare la pelle, gli occhi, la pelle, il naso e la gola..
-L'esposizione a livelli elevati può causare vertigini e svenimenti. Allo stesso modo, l'esposizione a lungo termine può influire sul fegato e sui reni..
-L'inalazione di acetato di etile a una concentrazione di 20.000 - 43.000 ppm può causare edema polmonare ed emorragia..
-Il limite di esposizione professionale è stato fissato dall'OSHA a 400 ppm in aria, calcolato in media su un turno di lavoro di 8 ore..
Riferimenti
- Steven A. Hardinger. (2017). Glossario illustrato di chimica organica: acetato di etile (EtOAc). Estratto da: chem.ucla.edu
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10th edizione.). Wiley plus.
- Morrison, R. T. e Boyd, R. N. (1990). Chimica organica. (5ta edizione). Editoriale Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Acetato di etile. Estratto da: en.wikipedia.org
- Cotton S. (s.f.). Acetato di etile. Estratto da: chm.bris.ac.uk
- PubChem. (2019). Acetato di etile. Estratto da: pubchem.ncbi.nlm.nih.gov
- Newseed Chemical. (2018). Applicazioni e usi dell'acetato di etile. Estratto da: foodsweeteners.com
- Dipartimento della salute dei servizi per anziani del New Jersey. (2002). Acetato di etile. [PDF]. Estratto da: nj.gov



Nessun utente ha ancora commentato questo articolo.